Цезий — это… Что такое Цезий?
| Внешний вид простого вещества | |
|---|---|
| Очень мягкий вязкий серебристо-жёлтый, похожий на золото металл | |
| Свойства атома | |
| Имя, символ, номер | Цезий / Caesium (Cs), 55 |
| Атомная масса (молярная масса) | 132,90543 а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 6s1 |
| Радиус атома | 267 пм |
| Химические свойства | |
| Ковалентный радиус | 235 пм |
| Радиус иона | (+1e) 167 пм |
| Электроотрицательность | 0,79 (шкала Полинга) |
| Электродный потенциал | -2,923 |
| Степени окисления | 1 |
| Энергия ионизации (первый электрон) | 375,5 (3,89) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,873 г/см³ |
| Температура плавления | 28,7 °C[1] 28,5°С[2] 28,44°С[3] |
| Температура кипения | 667,6 °C[1] 688 °C[2] 669,2 °C[3] |
| Теплота плавления | 2,09 кДж/моль |
| Теплота испарения | 68,3 кДж/моль |
| Молярная теплоёмкость | 32,21[3] Дж/(K·моль) |
| Молярный объём | 70,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая |
| Параметры решётки | 6,140 Å |
| Температура Дебая | 39,2 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 35,9 Вт/(м·К) |
Це́зий (лат. Caesium, обозначается символом Cs) — элемент главной подгруппы первой группы шестого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 55. Простое вещество цезий (CAS-номер: 7440-46-2) — мягкий щелочной металл серебристо-жёлтого цвета. Своё название цезий получил за наличие двух ярких синих линий в эмиссионном спектре (от лат.
История
Цезий был открыт в 1860 году немецкими учёными Р. В. Бунзеном и Г. Р. Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии, тем самым, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий впервые был выделен в 1882 году шведским химиком К. Сеттербергом при электролизе расплава смеси цианида цезия (CsCN) и бария.
Нахождение в природе
Цезий входит в группу химических элементов с ограниченными запасами[источник не указан 679 дней
Месторождения
По добыче цезиевой руды (поллуцита) лидирует Канада. В месторождении Берник-Лейк (юго-восточная Манитоба) сосредоточено около 70 % мировых запасов цезия. Поллуцит также добывается в Намибии и Зимбабве. В России его мощные месторождения находятся на Кольском полуострове, в Восточном Саяне и Забайкалье. Месторождения поллуцита также имеются в Казахстане, Монголии и Италии (о. Эльба), но они обладают малыми запасами и не имеют важного экономического значения.
Геохимия и минералогия
Среднее содержание цезия в земной коре 3,7 г/т. Наблюдается некоторое увеличение содержание цезия от ультраосновных пород (0,1 г/т) к кислым (5 г/т). Основная его масса в природе находится в рассеянной форме и лишь незначительная часть заключена в собственных минералах. Постоянно повышенные количества цезия наблюдаются в воробьевите (1—4 %), родиците (около 5 %), авогадрите и лепидолите (0,85 %). По кристаллохимическим свойствам цезий наиболее близок к рубидию, калию и таллию. В повышенных количествах цезий находится в калиевых минералах. Цезий, как и рубидий, имеет тенденцию накапливаться на поздних стадиях магматических процессов, и в пегматитах его концентрации достигают наивысших значений. Среднее содержание цезия в гранитных пегматитах около 0,01 %, а в отдельных пегматитовых жилах, содержащих поллуцит, даже достигает 0,4 %, что примерно в 400 раз выше, чем в гранитах. Наиболее высокие концентрации цезия наблюдаются в редкометально замещённых микроклин-альбитовых пегматитах со сподуменом. При пневматолито-гидротермальном процессе повышенные количества цезия связанны с массивами грейзенезированных аляскитов и гранитов с кварц-берилл-вольфрамитовыми жилами, где он присутствует главным образом в мусковитах и полевых шпатах. В зоне гипергенеза (в поверхностных условиях) цезий в небольшом количестве накапливается в глинах, глинистых породах и почвах, содержащих глинистые минералы, иногда в гидроокислах марганца. Максимальное содержание цезия составляет лишь 15 г/т. Роль глинистых минералов сводится к сорбции, цезий вовлекается в межпакетное пространство в качестве поглощённого основания. Активная миграция этого элемента в водах очень ограничена. Основное количество цезия мигрирует «пассивно», в глинистых частичках речных вод. В морской воде концентрация цезия составляет ок. 0,5 мкг/л.
Получение
Основными цезиевыми минералами являются поллуцит и очень редкий авогадрит (K,Cs)[BF
При промышленном получении цезий в виде соединений извлекается из минерала поллуцита. Это делается хлоридным или сульфатным вскрытием. Первое включает обработку исходного минерала подогретой соляной кислотой, добавление хлорида сурьмы SbCl3 для осаждения соединения Cs3[Sb2Cl9] и промывку горячей водой или раствором аммиака с образованием хлорида цезия CsCl. При втором — минерал обрабатывается подогретой серной кислотой с образованием алюмоцезиевых квасцов CsAl(SO
В России после распада СССР промышленная добыча поллуцита не велась, хотя в Вороньей тундре под Мурманском ещё в советское время были обнаружены колоссальные запасы минерала. К тому времени, когда российская промышленность смогла встать на ноги, выяснилось, что лицензию на разработку этого месторождения купила Канадская компания[источник не указан 1279 дней]. В настоящее время переработка и извлечение солей цезия из поллуцита ведется в Новосибирске на ЗАО «Завод редких металлов».
Существует несколько лабораторных методов получения цезия[5]. Он может быть получен:
Все методы являются трудоёмкими. Второй позволяет получить высокочистый металл, однако является взрывоопасным и требует на реализацию несколько суток.
Изотопы
Природный цезий — мононуклидный элемент, состоящий из единственного стабильного нуклида 133Cs. На сегодняшний день известно 39 искусственных радиоактивных изотопов цезия с массовыми числами от 112 до 151[6] (бо́льшая часть известных изотопов цезия приводится в таблице нуклидов). Самым долгоживущим искусственным радиоактивным нуклидом цезия является периодом полураспада T1/2 около 2,3 миллиона лет. Другой относительно долгоживущий изотоп 137Cs (T1/2=30,17 года). Оба эти долгоживущих радионуклида являются продуктами ядерного распада. Цезий-137 является одним из виновников радиоактивного загрязнения биосферы, так как образуется при делении ядер.
Физические свойства
Кристаллы цезияЦезий — мягкий металл, из-за низкой температуры плавления (Tпл=28,6 °C) при комнатной температуре находится в полужидком состоянии. Металлический цезий представляет собой вещество золотисто-белого цвета, по внешнему виду похожее на золото, но светлее. Расплав представляет подвижную жидкость, при этом его цвет становится более серебристым. Жидкий цезий хорошо отражает свет. Пары цезия окрашены в зеленовато-синий цвет.
Кристаллизуется цезий в объёмноцентрированную кубическую решётку (тип α-железа), пространственная группа I m3m, a = 0,6141 нм, Z = 2. При высоком давлении может переходить в другие полиморфные модификации[7]. Цезий — парамагнетик.
Цезий растворяется в жидком аммиаке (тёмно-синие растворы) и расплавленном CsOH.
Химические свойства
Цезий является наиболее химически активным металлом, полученным в макроскопических количествах (так как активность щелочных металлов растёт с порядковым номером, то франций, вероятно, ещё более активен, но в макроскопических количествах не получен, так как все его изотопы имеют малый период полураспада). Является сильнейшим восстановителем. На воздухе цезий мгновенно окисляется с воспламенением, образуя надпероксид CsO2. При ограниченном доступе кислорода окисляется до оксида Cs2O. Взаимодействие с водой происходит со взрывом, продуктом взаимодействия являются гидроксид CsOH и водород H2. Цезий вступает в реакцию со льдом (даже при −120 °C), простыми спиртами, галогеноорганическими соединениями, галогенидами тяжёлых металлов, кислотами, сухим льдом (взаимодействие протекает с сильным взрывом). Реагирует с бензолом. Активность цезия обусловлена не только высоким отрицательным электрохимическим потенциалом, но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, что увеличивает скорость реакции). Многие образуемые цезием соли — нитраты, хлориды, бромиды, фториды, иодиды, хроматы, манганаты, азиды, цианиды, карбонаты и т. д. — чрезвычайно легко растворимы в воде и ряде органических растворителей; наименее растворимы перхлораты (что важно для технологии получения и очистки цезия). Несмотря на то, что цезий является весьма активным металлом, он, в отличие от лития, не вступает в реакцию с азотом при обычных условиях и, в отличие от бария, кальция, магния и ряда других металлов, не способен образовать с азотом соединений даже при сильнейшем нагревании.
Гидроксид цезия — сильнейшее основание с высочайшей электропроводностью в водном растворе; так, например, при работе с ним необходимо учитывать, что концентрированный раствор CsOH разрушает стекло даже при обычной температуре, а расплав разрушает железо, кобальт, никель, а также платину, корунд и диоксид циркония, и даже постепенно разрушает серебро и золото (в присутствии кислорода — очень быстро). Единственным устойчивым в расплаве гидроксида цезия металлом является родий и некоторые его сплавы.
Применение
Цезий нашёл применение только в начале XX века, когда были обнаружены его минералы и разработана технология получения в чистом виде. В настоящее время цезий и его соединения используются в электронике, радио-, электро-, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике. В основном применяется стабильный природный цезий-133, и ограниченно — его радиоактивный изотоп цезий-137, выделяемый из суммы осколков деления урана, плутония, тория в реакторах атомных электростанций.
Фотоэлементы, фотоумножители
Благодаря крайне низкой работе выхода электрона, цезий используется при производстве высокочувствительных и малоинерционных фотоэлектрических приборов — фотоэлементов, фотоумножителей. В фотоэлементах цезий обычно применяется в виде сплавов с сурьмой, кальцием, барием, алюминием, или серебром, которые вводятся для повышения эффективности устройства, а также для экономии чрезвычайно дорогого цезия. Такие фотоэлементы способны работать в широком диапазоне длин волн: от дальней инфракрасной, до коротковолновой ультрафиолетовой области электромагнитного излучения, что делает цезиевые фотоэлементы эффективнее рубидиевых.
Детекторы ионизирующего излучения
Иодид цезия в виде монокристаллов (обычно активированный небольшой примесью таллия) является одним из наиболее распространённых сцинтилляторов — веществ, конвертирующих энергию ионизирующего излучения в свет. Это связано с высокой эффективностью поглощения гамма-квантов из-за большого атомного номера обоих основных составляющих иодида цезия, а также с высоким световыходом этого сцинтиллятора. Детекторы заряженных частиц и гамма-излучения на его основе применяются в атомной технике, геологии, медицине, космических исследованиях. Так, например, измерения элементного состава поверхности Марса выполнялись с помощью гамма-спектрометра на основе CsI(Tl), установленного на космическом орбитальном аппарате «Марс-5». Недостатком этого сцинтиллятора является его гигроскопичность, не позволяющая использовать его без герметичной оболочки.
Оптика
Иодид и бромид цезия применяются в качестве оптических материалов в специальной оптике — инфракрасные приборы, очки и бинокли ночного видения, прицелы, обнаружение техники и живой силы противника (в том числе из космоса).
Источники света
В электротехнике цезий применяется в изготовлении светящихся трубок, в виде соединений с цирконием или оловом (метацирконаты и ортостаннаты цезия). Наряду с другими металлами цезий используется для наполнения осветительных газоразрядных металлогалогеновых ламп.
Катализаторы
Цезий нашёл большое применение в производственной химии в качестве катализатора (органический и неорганический синтез). Каталитическая активность цезия используется в процессах получения аммиака, серной кислоты, бутилового спирта, в реакциях дегидрогенизации и при получении муравьиной кислоты. Особенно эффективным является применения цезия как промотора при каталитическом получении аммиака, синтезе бутадиена, и имеет очень большое экономическое значение так как резко увеличивает эффективность синтеза. Очень большое значение приобрел рутений-цезий-углеродный катализатор. В целом применение цезия в катализе имеет не только большую сферу его потребления но и большие перспективы дальнейшего развития. В ряде катализаторов оказалось чрезвычайно эффективным применение цезия совместно с рубидием (оба металла значительно увеличивают каталитическую активность друг друга). Цезий промотирует действие серебряного катализатора и повышает его селективность при эпоксидировании этилена.
Химические источники тока
На основе цезия создан и применяется высокоэффективный твёрдый электролит для топливных элементов (в том числе автомобильных), и аккумуляторов чрезвычайно высокой энергоёмкости — цезий-бета-глинозём (алюминат цезия).
Изотопы
Схема распада Cs-137.Радиоактивный нуклид цезий-137 претерпевает бета-распад (период полураспада 30,17 лет, продукты распада барий-137m, быстро распадающийся с излучением гамма-кванта с энергией 661,7 кэВ в основное состояние, и барий-137). Гамма-излучение цезия-137 используется в гамма-дефектоскопии, измерительной технике и при стерилизации пищевых продуктов (консервы, туши птиц и животных, мяса), а также для стерилизации медицинских препаратов и лекарств, в радиотерапии для лечения злокачественных опухолей. Также цезий-137 используется в производстве радиоизотопных источников тока, где он применяется в виде хлорида цезия (плотность 3,9 г/см³, энерговыделение около 1,27 Вт/см³). Цезий-137 используется в датчиках предельных уровней сыпучих веществ в непрозрачных бункерах.
Единственный стабильный нуклид цезий-133 используется в атомных часах.
Медицина
На основе соединений цезия созданы эффективные лекарственные препараты для лечения язвенных заболеваний, дифтерии, шоков, шизофрении.
Применение цезия в энергетике и космосе
Значительной сферой применения металлического цезия являются новейшие и стремительно развивающиеся работы и производство энергетических агрегатов. Цезиевая плазма является важнейшей и неотъемлемой компонентой МГД-генераторов с повышенным КПД до 65—70 %. Ионизированые пары цезия являются лучшим рабочим телом для ионных двигателей в космосе.[источник не указан 1309 дней]
Сплав цезия с барием является лучшим [источник не указан 1309 дней] из известных материалов для выпрямления сверхмощных потоков электроэнергии (превосходя в этом отношении ртутные и полупроводниковые вентили) и в будущем займёт важнейшее положение в большой энергетике и космических электроракетных установках. Одним из его отличительных особенностей является возможность выпрямления и коммутирования чудовищных мощностей в импульсном режиме. Ввиду того, что цезий имеет большую теплоёмкость, теплопроводность и ряд собственных сплавов с очень низкой температурой плавления (цезий 94,5 % и натрий 5,5 %) −30 °C, то используется в качестве теплоносителя в атомных реакторах и высокотемпературных турбоэнергетических установках, а сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C среди сплавов.
В течение последних 25 лет цезий исследуется в мире[источник не указан 303 дня] как материя Ридберга (конденсат возбуждённых состояний цезия КВС), по предварительным оценкам, сделанным экспериментально в Швеции и России, КВС цезия при температуре менее 700 K имеет весьма высокую электропроводность и работу выхода менее 1 эВ и вплоть до 0,2 эВ, что позволяет применить металлический цезий для производства высокоэффективных источников тока, электростанций, утилизации тепла (например тепла продуктов сгорания автомобилей). Конденсат возбуждённых состояний цезия образуется при прокачке его паров сквозь перфорированный (губчатый) материал коллектора, имеющий на своей поверхности тончайший слой углерода или окислов (например, карбид гафния, ниобия или тантала). Для исследования КВС цезия применяется растровое лазерное сканирование, оптическая спектроскопия и съёмка видеокамерой, и уже в ходе первых исследований были обнаружены аномальные явления, проявившие себя в образовании кластеров капельной плазменной фракции, окрашенной в зеленые тона, и резком уменьшении работы выхода коллектора.
Металлургия
Металлический цезий на заре поисков его ассимиляции в промышленности обнаружил свойство резко повышать жаропрочность магния и алюминия, так например добавка 0,3—0,4 % цезия к магнию в 3 раза повышает [источник не указан 1309 дней] его прочность на разрыв и резко улучшает его коррозионную стойкость, но ввиду весьма высокой цены, и наличия других более дешёвых металлов для легирования он не применяется для этой цели.
Высокотемпературная сверхпроводимость
Недавно[когда?] найдено, что продукты внедрения цезия в графит (фуллериды) обладают свойством высокотемпературной сверхпроводимости и интенсивно изучаются.
Производство лазеров
В последние годы цезий изучается как рабочее тело и излучательная среда для создания лазеров, имеющих рекордные значения пиковых мощностей как в непрерывном, так и в импульсном режиме работы. В значительной степени этот интерес и капиталовложения направлены на разработку лазеров для вооружения и в области получения термоядерной энергии.[источник не указан 303 дня]
Производство электродов
Цезий используется[источник не указан 303 дня] в качестве добавки к вольфраму для производства электродов мощных осветительных дуговых ламп и электродов, применяемых для сварки алюминия, магния, титана, церия, нержавеющей стали и целого ряда активных сплавов в среде аргона, гелия и водорода. Применение этой добавки (около 0,1—0,35 %) в значительной степени облегчает зажигание и горение дуги при низком напряжении.
Термоэлектрические материалы
Цезий исследуется как компонент Пельтье-охладителей. Оказалось[источник не указан 303 дня], что сплав сверхчистого висмута, сверхчистого теллура и сверхчистого цезия эффективен для создания охладителей, основанных на эффекте Пельтье[источник не указан 1309 дней]. Как показывает практический опыт эксплуатации этого нового полупроводникового материала, его использование наиболее эффективно именно в новейших суперпроцессорах на основе нитрида бора и монокристаллического алмаза в качестве теплоотвода и основы схемы. Применение этого материала открывает широкие возможности для повышения быстродействия микроэлектроники. В опытах с этим новым полупроводниковым материалом удалось на сегодняшний день получить охлаждение вплоть до −237 °C, что позволяет создавать микрохолодильники для охлаждения мощных процессоров (в том числе нанопроцессоров), холодильники для глубокой заморозки тканей и клеточного материала, сжижения газов, охлаждения лазерных систем, тепловизоров, а в перспективе для охлаждения высокотемпературных сверхпроводников для высокоскоростного транспорта на «магнитной подушке». Очень важным направлением использования данного полупроводника ряд специалистов[кто?] рассматривает создание лазеров на монокристаллах алмаза с очень высоким КПД и возможностью работы в пикосекундном диапазоне, что очень важно для конструирования оптоэлектронных систем для обработки информации. Ведущей страной в этой новой области использования является Япония.
Оптические материалы микроэлектроники
Триборат цезия и триборат цезия-лития, а также фосфат цезия-галлия используются как специальные оптические материалы в новейших областях радиоэлектроники.[источник не указан 303 дня]
Пьезоэлектрические материалы
Дигидрофосфат цезия в 7 раз более эффективный пьезоэлектрик, чем кварц [источник не указан 1309 дней]. Хотя несколько уступает по эффективности сегнетовой соли, он более устойчив к влаге, чем последняя.
Атомно-водородная энергетика
Металлический цезий используется[источник не указан 1309 дней] в атомно-водородной энергетике при разложении воды термохимическим способом (цикл «Аэроджет Дженерал»).
Защита воздушных судов
Цезий применяется в производстве специальных ламп[источник не указан 1309 дней] с электронным управлением для создания тепловых помех для ракет противника. Такие цезиевые лампы устанавливаются на современных боевых самолётах и в значительной степени повышают живучесть самолетов в бою.
Прочие области применения цезия
Фторид цезия применяют для получения фторорганических соединений [источник не указан 1309 дней], пьезоэлектрической керамики, специальных стёкол. Хлорид цезия — электролит в топливных элементах, флюс при сварке молибдена.
Биологическая роль
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии.[8]
Цезий в живых организмах
Цезий в живых организмах — постоянный химический микроэлемент организма растений и животных. Морские водоросли например содержат от 0,01-0,1 мкг цезия в 1 г сухого вещества, наземные растения — 0,05—0,2. Животные получают цезий с водой и пищей. В организме членистоногих около 0,067—0,503 мкг/г цезия, пресмыкающихся — 0,04, млекопитающих — 0,05. Главное депо цезия в организме млекопитающих — мышцы, сердце, печень; в крови — до 2,8 мкг/л цезий относительно малотоксичен; его биологическая роль в организме растений и животных окончательно не раскрыта.
Цезий-137 — радиоактивный изотоп цезия, испускающий бета-излучение и гамма-кванты, и один из главных компонентов техногенного радиоактивного загрязнения биосферы. Продукт деления урана-235, урана-238, плутония-244 и других делящихся изотопов. Содержится в радиоактивных выпадениях, радиоактивных отходах, сбросах заводов, перерабатывающих отходы атомных электростанций. Интенсивно сорбируется почвой и донными отложениями; в воде находится преимущественно в виде ионов. Содержится в растениях и организме животных и человека. Коэффициент накопления Cs-137 наиболее высок у пресноводных водорослей и арктических наземных растений, особенно лишайников. В организме животных Cs-137 накапливается главным образом в мышцах и печени. Наибольший коэффициент накопления его отмечен у северных оленей и североамериканских водоплавающих птиц. Накапливается в грибах, ряд которых (маслята, моховики, свинушка, горькушка, польский гриб) считается «аккумуляторами» радиоцезия[9].
Интересные факты
Цезий — самый мягкий металл при комнатной температуре.[10] Также, как и галлий, его можно расплавить в руках (однако, естественно, это можно сделать только при условии, что цезий запаян в стеклянную ампулу, иначе происходит его возгорание).
Примечания
Ссылки
Литература
- Перельман Ф. М. Рубидий и цезий. М., Изд-во АН УССР, 1960. 140 стр. с илл.
- Кульварская Б. С., Соболева Н. А., Татаринова Н. В. Композиционные соединения щелочных металлов — новые эффективные источники ионов и электронов. Изв. АН СССР. Сер. физич.; 1988. Т.52. № 8. С.1509-1512.
- Плющев В. Е., Степин Б. Д. Химия и технология соединений лития, рубидия и цезия.— М.-Л.: Химия, 1970.- 407 с
- Солодов Н. А., Рубидий и цезий, М., 1971;
- Плющев В. Е., Степин Б. Д., Аналитическая химия рубидия и цезия, М., 1975
- Коган Б. И., Названова В. А., Солодов Н. А., Рубидий и цезий, М., 1971;
- Моисеев А. А., Рамзаев П. В., Цезий-137 в биосфере, М., 1975;
- Mattsson S., Radionuclides in lichen, reindeer and man, Lund, 1972.
| Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
| ||||||||||||
| Библиоинформация: SWD in the DNB: 4147131-3 |
dic.academic.ru
Щелочные металлы в химии
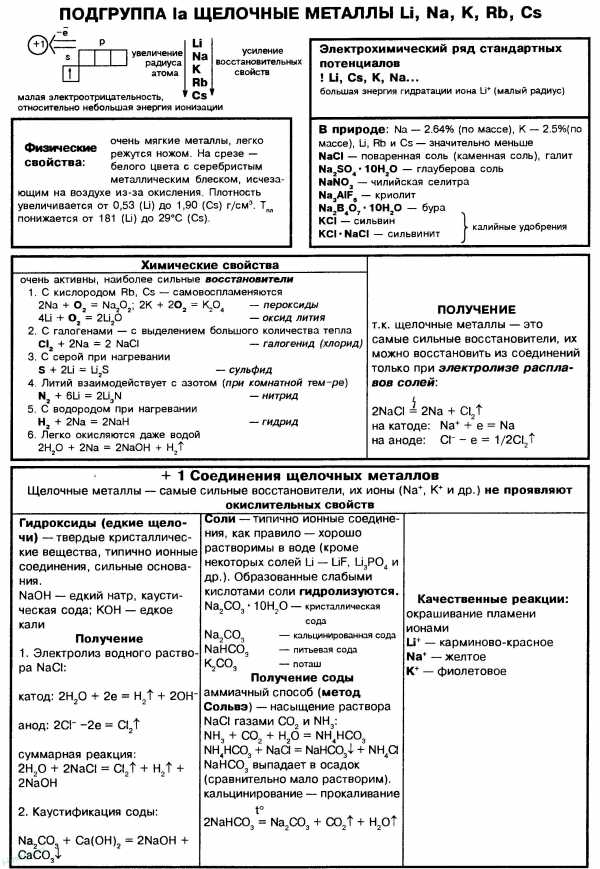
К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns1. В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
2LiCl = 2Li + Cl2↑
2NaCl = 2Na + Cl2↑
Любой щелочной металл можно получить восстановлением соответствующего галогенида (хлорида или бромида), применяя в качестве восстановителей Ca, Mg или Si. Реакции проводят при нагревании (600 – 900С) и под вакуумом. Уравнение получения щелочных металлов таким способом в общем виде:
2MeCl + Ca = 2Mе↑ + CaCl2,
где Ме – металл.
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
2Li2O + Si + 2CaO = 4Li + Ca2SiO4
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
2Me + H2O = 2MeOH + H2↑
где Ме – металл.
Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
4Li + O2 = 2Li2O
2Na + O2 =Na2O2
K + O2 = KO2
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
2Na + Cl2 =2NaCl
6Li + N2 = 2Li3N
2Li +2C = Li2C2
2K + S = K2S
2Na + H2 = 2NaH
Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
2Li + 2NH3 = 2LiNH2 + H2↑
Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
3Na + AlCl3 = 3NaCl + Al
Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
2Na + 2C2H5OH = 2C2H5ONa + H2↑
2K + 2C6H5OH = 2C6H5OK + H2↑
2Na + 2CH3COOH = 2CH3COONa + H2↑
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li+ окрашивает пламя в красный цвет, Na+ — в желтый, а K+, Rb+, Cs+ — в фиолетовый.
Примеры решения задач
ru.solverbook.com
Характерные химические свойства щелочных металлов » HimEge.ru
•Восстановительная способность увеличивается в ряду ––Li–Na–K–Rb–Cs.
•Все соединения щелочных металлов имеют ионный характер.
•Практически все соли растворимы в воде.
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги. Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
1. Щелочные металлы активно взаимодействуют с водой:
2Na + 2H2O → 2NaOH + H2
2Li + 2H2O → 2LiOH + H2
2. Реакция щелочных металлов с кислородом:
4Li + O2 → 2Li2O (оксид лития)
2Na + O2 → Na2O2 ( пероксид натрия)
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
6Li + N2 → 2Li3N (нитриды)
2Li + 2C → Li2C2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
2Li + 2NH3 = 2LiNH2 + H2
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2;
2K + 2C6H5OH = 2C6H5OK + H2;
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:
Li+ – карминово-красный
Na+ – желтый
K+, Rb+ и Cs+ – фиолетовый
Получение щелочных металлов
Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl2
В небольших масштабах используется также вакуум-термическое получение натрия и калия:
2NaCl+CaC2=2Na+CaCl2+2C;
4KCl+4CaO+Si=4K+2CaCl2+Ca2SiO4.
Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).
 Особенности химических свойств s-элементов I группы и их физиологическое действие
Особенности химических свойств s-элементов I группы и их физиологическое действие
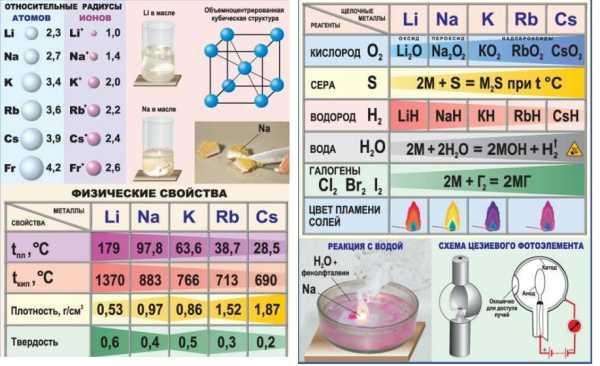
Электронная конфигурация атома лития 1s22s1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li+ со стабильной конфигурацией инертного газа (гелия). Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл. От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li+ сильно сольватирован; его окружают несколько десятков молекул воды. Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li+, высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е—, занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s22s22p63s1. Единственная степень окисления натрия +1. Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na+ значительно больше, чем Li+, и сольватация его не так велика. Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К+ и Na+ связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами. Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К+, вследствие чего внутриклеточная концентрация К+ значительно выше, чем ионов Na+ . В то же время в плазме крови концентрация Na+ превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток. Ионы К+ и Na+ ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния. Повышение же содержания ионов К+ вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb+, Cs+, Li+ еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв. Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте. При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов. В соединениях калия связь более ионная, а в виде иона К+ он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39К, 40К, 41К. Один из них 40К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа. Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е— на 4s-орбитали. Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р. Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей. Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации. Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (390C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах. Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно. Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах. В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li3N (до 75%) и Li2O. Остальные щелочные металлы образуют пероксиды (Na2O2) и надпероксиды (K2O4 или KO2).
Перечисленные вещества реагируют с водой:
Li3N + 3 H2O = 3 LiOH + NH3 ;
Na2O2 + 2 H2O = 2 NaOH + H2O2 ;
K2O4 + 2 H2O = 2 KOH + H2O2 + O2 .
Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
Na2O2+CO2=Na2CO3+0,5O2 ;
K2O4 + CO2 = K2CO3+ 1,5 O2 .
В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных.
Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
2Li+H2=2LiH.
Гидрид лития используется как сильный восстановитель.
Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
SiO2+2NaOH=Na2SiO3+H2O.
Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 13000С). Некоторые соединения натрия называют содами:
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na2CO3;
б) кристаллическая сода – кристаллогидрат карбоната натрия Na2CO3.10H2O;
в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO3;
г) гидроксид натрия NaOH называют каустической содой или каустиком.
himege.ru
цезий — это… Что такое цезий?
ЦЕ́ЗИЙ -я; м. [от лат. caesius — голубой] Химический элемент (Cs), мягкий щелочной металл серебристого цвета (используется в газовых лазерах).
◁ Це́зиевый, -ая, -ое. Ц. катод. Ц-ое покрытие.
ЦЕ́ЗИЙ (лат. Cesium), Cs (читается «цезий»), химический элемент с атомным номером 55, атомная масса 132,9054. Имеет один стабильный нуклид 133Cs. Расположен в группе IA в 6 периоде. Электронная конфигурация внешнего слоя 6s1, в соединениях проявляет степень окисления +1 (валентность I). Радиус нейтрального атома цезия 0,266 нм, радиус иона Cs+0,181 нм (координационное число 6), 0,202 (координационное число 12). Энергии последовательной ионизации атома 3,89397, 25,1 и 34,6 эВ. Сродство к электрону 0,47 эВ. Работа выхода электрона 1,81 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 0,7.Цезий был открыт в 1860 немецкими учеными Р. В. Бунзеном (см. БУНЗЕН Роберт Вильгельм) и Г. Кирхгофом (см. КИРХГОФ Густав Роберт) в водах Дюрхгеймского минерального источника в Германии методом спектрального анализа. Назван цезием по двум ярким линиям в синей части спектра (от лат. caesius — небесно-голубой). Металлический цезий впервые был выделен в 1882 шведским химиком К. Сеттербергом при электролизе расплава смеси CsCN и Ba.
Содержание в земной коре 3,7·10-4% по массе. Типичный редкий, рассеянный элемент. Геохимически тесно связан с гранитнлй магмой, образуя концентрации в пегматитах вместе с Li, Be, Ta, Nb. Известно два крайне редких минерала цезия: поллуцит, (Cs,Na)[AlSi2O6]·nH2O и авогадрит, (K,Сs)[BF]4. Как примесь, 0,0003—5%, цезий содержится в лепидолите (см. ЛЕПИДОЛИТ), флогопите (см. ФЛОГОПИТ), карналлите (см. КАРНАЛЛИТ).
Получение
Цезий получают из поллуцита методом вакуумтермического восстановления. Руду обогащают, затем выделенный концентрат разлагают соляной или серной кислотами или спекают с оксидно-солевыми смесями, СаО и СаСl2. Из продуктов разложения поллуцита цезий осаждают в виде CsAl(SO4)2 или Cs3[Sb2Cl9]. Далее осадки переводят в растворимые соли. Особо чистые соединения цезия получают дальнейшей дробной кристаллизацией, сорбцией, экстракцией и ионным обменом. Металлический цезий получают металлотермическим восстановлением хлорида цезия CsCl кальцием (см. КАЛЬЦИЙ) или магнием (см. МАГНИЙ) или электролизом расплава галогенидов (см. ГАЛОГЕНИДЫ) цезия. Хранят цезий в ампулах из стекла пирекс в атмосфере аргона или в стальных герметичных сосудах под слоем обезвоженного вазелинового или парафинового масла.
Физические и химические свойства
Цезий — мягкий серебристо-белый металл. При обычной температуре находится в пастообразном состоянии, температура плавления 28,44°C. Температура кипения 669,2°C. Кристаллическая решетка кубическая объемно центрированная, параметр ячейки а = 0,6141 нм. Плотность 1,904 кг/дм3. Цезий имеет высокую чувствительность к свету, цезиевый катод испускает электроны даже под действием инфракрасного (см. ИНФРАКРАСНОЕ ИЗЛУЧЕНИЕ) излучения с длиной волны до 0,80 мкм.
Цезий чрезвычайно реакционноспособен. Стандартный электродный потенциал –2,923 В. На воздухе и в атмосфере кислорода (см. КИСЛОРОД) цезий мгновенно воспламеняется, образуя смесь пероксида Сs2O2 и надпероксида цезия CsO2. При незначительном содержании кислорода в газе, с которым реагирует цезий, возможно образование оксида Cs2O. C водой цезий реагирует со взрывом:
2Cs + 2H2O = 2CsOH + H2
При нагревании под повышенным давлением в присутствии катализатора цезий реагирует с водородом с образованием гидрида CsH. Взаимодействуя с галогенами, дает галогениды CsCl, c серой — сульфид Cs2S. С азотом цезий в обычных условиях не реагирует, а нитрид цезия Cs3N образуется при пропускании электрического разряда между электродами из цезия, помещенными в жидкий азот. При нагревании цезий реагирует с красным фосфором, образуя фосфид Cs2P5.
При нагревании взаимодействует с графитом, давая следующие карбиды C8Cs, C24Cs, C36Cs, Cs2C2 (ацетиленид цезия). Цезий восстанавливает кремний из стекла и из SiO2. Со многими металлами цезий образует интерметаллиды (см. МЕТАЛЛИДЫ) (CsAu, CsSn4). Гидроксид цезия CsOH — сильное хорошо растворимое в воде основание. Соли цезия (хлорид CsCl, сульфат Cs2SO4, нитрат CsNO3, карбонат Cs2CO3 и другие) хорошо растворимы в воде. Плохо растворимы в воде перхлорат цезия CsClO4, хлорплатинат цезия Cs2PtCl6 и Cs2[Sb2Cl9].
Цезий — компонент различных фотокатодов, фотоэлементов, фотоэлектронных умножителей, электронно-лучевых трубок. Цезий используют как геттер. (см. ГЕТТЕР) Чрезвычайно точны «атомные цезиевые часы», резонансная частота энергетического перехода между подуровнями основного состояния 133Cs положена в основу современного определения секунды (см. СЕКУНДА). Радионуклид 137Cs источник гамма-излучения в радиологии.
Цезий — постоянный химический микрокомпонент организма растений и животных. Морские водоросли содержат 0,01—0,1 мкг/г цезия, наземные растения — 0,05—0,2 мкг/г. В организме млекопитающих содержится 0,05 мкг/г цезия, где он концентрируется в мышцах, сердце и печени. В крови до 2,8 мкг/л цезий относительно малотоксичен. Изотоп 137Cs b-, g-излучающий радиоизотоп, один из компонентов радиоактивного загрязнения атмосферы.
dic.academic.ru
ЦЕЗИЙ | Энциклопедия Кругосвет
Содержание статьиЦЕЗИЙ (Cesium) Cs, химический элемент 1-й (Ia) группы Периодической системы. Щелочной элемент. Атомный номер 55, относительная атомная масса 132,9054.
В природном цезии не удалось обнаружить какие-либо иные изотопы, кроме стабильного 133Cs. Известно 33 радиоактивных изотопа цезия с массовыми числами от 114 до 148. В большинстве случаев они недолговечны: периоды полураспада измеряются секундами и минутами, реже – несколькими часами или днями. Однако три из них распадаются не так быстро – это 134Cs, 137Cs и 135Cs с периодами полураспада 2 года, 30 лет и 3·106 лет. Все три изотопа образуются при распаде урана, тория и плутония в атомных реакторах или в ходе испытаний ядерного оружия.
Степень окисления +1.
В 1846 в пегматитах о.Эльба в Тирренском море был открыт силикат цезия – поллуцит. При изучении этого минерала неизвестный в то время цезий был принят за калий. Содержания калия вычислялось по массе соединения платины, с помощью которого элемент переводили в нерастворимое состояние. Так как калий легче цезия, то подсчет результатов химического анализа показывал нехватку около 7%. Эта загадка была разрешена только после открытия спектрального метода анализа немецкими учеными Робертом Бунзеном и Густавом Кирхгоффом в 1859. Бунзен и Кирхгофф открыли цезий в 1861. Первоначально он был найден в минеральных водах целебных источников Шварцвальда. Цезий стал первым из элементов, открытых методом спектроскопии. Его название отражает цвет наиболее ярких линий в спектре (от латинского caesius – небесно-голубой).
Первооткрывателям цезия не удалось выделить этот элемент в свободном состоянии. Металлический цезий был впервые получен только через 20 лет, в 1882, шведским химиком К.Сеттербергом (Setterberg C.) при электролизе расплавленной смеси цианидов цезия и бария, взятых в отношении 4:1. Цианид бария добавлялся для снижения температуры плавления, однако работать с цианидами было трудно ввиду их высокой токсичности, а барий загрязнял конечный продукт, да и выход цезия был весьма мал. Более рациональный способ был найден в 1890 известным русским химиком Н.Н.Бекетовым, предложившим восстанавливать гидроксид цезия металлическим магнием в потоке водорода при повышенной температуре. Водород заполнял прибор и препятствовал окислению цезия, который отгонялся в специальный приемник, однако и в этом случае выход цезия не превышал 50% от теоретического.
Цезий в природе и его промышленное извлечение.
Содержание цезия в земной коре оценивается в 2,6·10–4%. Он распространен примерно так же, как бром, гафний и уран.
Цезий относится к редким элементам. Он встречается в рассеянном состоянии (порядка тысячных долей процента) во многих горных породах; ничтожные количества этого металла были обнаружены и в морской воде. В большей концентрации (до нескольких десятых процента) он содержится в некоторых калиевых и литиевых минералах, главным образом, в лепидолите. В отличие от рубидия и большинства других редких элементов, цезий образует собственные минералы – поллуцит, авогадрит и родицит.
Родицит крайне редок. Его часто относят к литиевым минералам, так как в его состав (М2O·2Al2O3·3B2O3, где М2O – сумма оксидов щелочных металлов) лития обычно входит больше, чем цезия. Авогадрит (K,Cs)[BF4] тоже редок. Больше всего цезия содержится в поллуците (Cs,Na)[AlSi2O6]·nH2O (содержание Cs2O составляет 29,8–36,7% по массе).
Данные по мировым ресурсам цезия очень ограничены. Их оценки основаны на поллуците, добываемом в качестве побочного продукта вместе с другими пегматитовыми минералами.
По добыче поллуцита лидирует Канада. В месторождении Берник-Лейк (юго-восточная Манитоба) сосредоточено 70% мировых запасов цезия (ок. 73 тыс. т). Поллуцит добывают также в Намибии и Зимбабве, ресурсы которых оценивают в 9 тыс. т и 23 тыс. т цезия, соответственно. В России месторождения поллуцита находятся на Кольском п-ове, в Восточных Саянах и Забайкалье. Имеются они также в Казахстане, Монголии и Италии (о. Эльба).
Чтобы вскрыть этот минерал и перевести ценные компоненты, в растворимую форму его обрабатывают при нагревании концентрированными минеральными кислотами. Если поллуцит разлагают соляной кислотой, то из полученного раствора действием SbCl3 осаждают Cs3[Sb2Cl9], который затем обрабатывают горячей водой или раствором аммиака. При разложении поллуцита серной кислотой получают алюмоцезиевые квасцы CsAl(SO4)2·12H2O.
Используют и другой способ: поллуцит спекают со смесью оксида и хлорида кальция, спек выщелачивают в автоклаве горячей водой, раствор выпаривают досуха с серной кислотой, а остаток обрабатывают горячей водой. После отделения сульфата кальция из раствора выделяют соединения цезия.
Современные методы извлечения цезия из поллуцита основаны на предварительном сплавлении концентратов с избытком извести и небольшим количеством плавикового шпата. Если процесс вести при 1200° C, то почти весь цезий возгоняется в виде оксида Cs2O. Этот возгон загрязнен примесью других щелочных металлов, однако он растворим в минеральных кислотах, что упрощает дальнейшие операции. Металлический цезий извлекают, нагревая до 900° С смеси (1:3) измельченный поллуцит с кальцием или алюминием.
Но, в основном, цезий получают как пробочный продукт при производстве лития из лепидолита. Лепидолит предварительно сплавляют (или спекают) при температуре около 1000° С с гипсом или сульфатом калия и карбонатом бария. В этих условиях все щелочные металлы превращаются в легкорастворимые соединения – их можно выщелачивать горячей водой. После выделения лития остается переработать полученные фильтраты, и здесь самая трудная операция – отделение цезия от рубидия и громадного избытка калия.
Для разделения цезия, рубидия и калия и получения чистых соединений цезия применяют методы многократной кристаллизации квасцов и нитратов, осаждения и перекристаллизации Cs3[Sb2Cl9] или Cs2[SnCl6]. Используют также хроматографию и экстракцию. Для получения соединений цезия высокой чистоты применяют полигалогениды.
Бóльшую часть производимого цезия выделяют в ходе получения лития, поэтому когда в 1950-х литий начали использовать в термоядерных устройствах и широко применять в автомобильных смазках, добыча лития, как и цезия возросла и соединения цезия стали доступнее, чем прежде.
Данные по мировому производству и потреблению цезия и его соединений не публикуются с конца 1980-х. Рынок цезия небольшой, и его ежегодное потребление оценивается всего лишь в несколько тысяч килограммов. В результате нет торговли и официальных рыночных цен.
Характеристика простого вещества, промышленное получение и применение металлического цезия.
Цезий – золотисто-желтый металл, один из трех интенсивно окрашенных металлов (наряду с медью и золотом). После ртути – это самый легкоплавкий металл. Плавится цезий при 28,44° С, кипит при 669,2° С. Его пары окрашены в зеленовато-синий цвет.
Легкоплавкость цезия сочетается с большой легкостью. Несмотря на довольно большую атомную массу элемента, его плотность при 20° С составляет всего 1,904 г/см3. Цезий много легче своих соседей по Периодической таблице. Лантан, например, имеющий почти такую же атомную массу, по плотности превосходит цезий в три с лишним раза. Цезий всего вдвое тяжелее натрия, в то время как их атомные массы относятся, как 6:1. По-видимому, причина этого кроется в электронной структуре атомов цезия (один электрон на последнем s-подуровне), приводящей к тому, что металлический радиус цезия очень велик (0,266 нм).
У цезия есть еще одно весьма важное свойство, связанное с его электронной структурой, – он теряет свой единственный валентный электрон легче, чем любой другой металл; для этого необходима очень незначительная энергия – всего 3,89 эВ, поэтому, например, получение плазмы из цезия требует гораздо меньших энергетических затрат, чем при использовании любого другого химического элемента.
По чувствительности к свету цезий превосходит все другие металлы. Цезиевый катод испускает поток электронов даже под действием инфракрасных лучей с длиной волны 0,80 мкм. Максимальная электронная эмиссия наступает у цезия при освещении зеленым светом, тогда как у других светочувствительных металлов этот максимум проявляется лишь при воздействии фиолетовых или ультрафиолетовых лучей.
Химически цезий очень активен. На воздухе он мгновенно окисляется с воспламенением, образуя надпероксид CsO2 с примесью пероксида Cs2O2. Цезий способен поглощать малейшие следы кислорода в условиях глубокого вакуума. С водой он реагирует со взрывом с образованием гидроксида CsOH и выделением водорода. Цезий взаимодействует даже со льдом при –116° C. Его хранение требует большой осторожности.
Цезий взаимодействует и с углеродом. Только самая совершенная модификация углерода – алмаз – в состоянии противостоять цезию. Жидкий расплавленный цезий и его пары разрыхляют сажу, древесный уголь и даже графит, внедряясь между атомами углерода и давая довольно прочные соединения золотисто-желтого цвета. При 200–500° С образуется соединение состава C8Cs5, а при более высоких температурах – C24Cs, C36Cs. Они воспламеняются на воздухе, вытесняют водород из воды, а при сильном нагревании разлагаются и отдают весь поглощенный цезий.
Даже при обычной температуре реакции цезия с фтором, хлором и другими галогенами сопровождаются воспламенением, а с серой и фосфором – взрывом. При нагревании цезий соединяется с водородом. С азотом в обычных условиях цезий не взаимодействует. Нитрид Cs3N образуется в реакции с жидким азотом при электрическом разряде между электродами, изготовленными из цезия.
Цезий растворяется в жидком аммиаке, алкиламинах и полиэфирах, образуя синие растворы, обладающие электронной проводимостью. В аммиачном растворе цезий медленно реагирует с аммиаком с выделением водорода и образованием амида CsNH2.
Сплавы и интерметаллические соединения цезия сравнительно легкоплавки. Аурид цезия CsAu, в котором между атомами золота и цезия реализуется частично ионная связь, является полупроводником n-типа.
Наилучшее решение задачи получения металлического цезия было найдено в 1911 французским химиком А.Акспилем. По его методу, до сих пор остающемуся наиболее распространенным, хлорид цезия восстанавливают металлическим кальцием в вакууме:
2CsCl + Ca → CaCl2 + 2Cs
при этом реакция идет практически до конца. Процесс ведут при давлении 0,1–10 Па и температуре 700–800° С. Выделяющийся цезий испаряется и отгоняется, а хлористый кальций полностью остается в реакторе, так как в этих условиях летучесть соли ничтожна (температура плавления CaCl2 равна 773° С). В результате повторной дистилляции в вакууме получается абсолютно чистый металлический цезий.
Описаны и многие другие способы получения металлического цезия из его соединений. Металлический кальций можно заменить его карбидом, однако при этом температуру реакции приходится повышать до 800° С, поэтому конечный продукт загрязняется дополнительными примесями. Проводят также электролиз расплава галогенида цезия с использованием жидкого свинцового катода. В результате получают сплав цезия со свинцом, из которого металлический цезий выделяют дистилляцией в вакууме.
Можно разлагать азид цезия или восстанавливать цирконием его дихромат, однако эти реакции иногда сопровождаются взрывом. При замене дихромата цезия хроматом процесс восстановления протекает спокойно, и хотя выход не превышает 50%, отгоняется очень чистый металлический цезий. Этот способ применим для получения небольших количеств металла в специальном вакуумном приборе.
Мировое производство цезия сравнительно невелико.
Металлический цезий – компонент материала катодов для фотоэлементов, фотоэлектронных умножителей, телевизионных передающих электронно-лучевых трубок. Фотоэлементы со сложным серебряно-цезиевым фотокатодом особенно ценны для радиолокации: они чувствительны не только к видимому свету, но и к невидимым инфракрасным лучам и, в отличие, например, от селеновых, работают безинерционно. В телевидении и кино широко распространены сурьмяно-цезиевые фотоэлементы; их чувствительность даже после 250 часов работы падает всего на 5–6%, они надежно работают в интервале температур от –30° С до +90° С. Из них составляют так называемые многокаскадные фотоэлементы; в этом случае под действием электронов, вызванных лучами света в одном из катодов, наступает вторичная эмиссия – электроны испускаются добавочными фотокатодами прибора. В результате общий электрический ток, возникающий в фотоэлементе, многократно усиливается. Усиление тока и повышение чувствительности достигаются также при заполнении цезиевых фотоэлементов инертным газом (аргоном или неоном).
Металлический цезий служит для изготовления специальных выпрямителей, во многих отношениях превосходящих ртутные. Его используют в качестве теплоносителя в ядерных реакторах, компонента смазочных материалов для космической техники, геттера в вакуумных электронных приборах. Металлический цезий проявляет и каталитическую активность в реакциях органических соединений.
Цезий используется в атомных стандартах времени. «Цезиевые часы» необыкновенно точны. Их действие основано на переходах между двумя состоянием атома цезия с параллельной и антипараллельной ориентацией собственных магнитных моментов ядра атома и валентного электрона. Этот переход сопровождается колебаниями со строго постоянными характеристиками (длина волны 3,26 см). В 1967 Международная генеральная конференция по мерам и весам установила: «Секунда – время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133».
В последнее время большое внимание уделяется цезиевой плазме, всестороннему изучению ее свойств и условий образования, возможно, она станет использоваться в плазменных двигателях будущего. Кроме того, работы по исследованию цезиевой плазмы тесно связаны с проблемой управляемого термоядерного синтеза. Многие считают, что целесообразно создавать цезиевую плазму, используя тепловую энергию атомных реакторов.
Хранят цезий в стеклянных ампулах в атмосфере аргона или стальных герметичных сосудах под слоем обезвоженного вазелинового масла. Утилизируют остатки металла обработкой пентанолом.
Соединения цезия.
Цезий образует бинарные соединения с большинством неметаллов. Гидриды и дейтериды цезия легко воспламеняются на воздухе, а также в атмосфере фтора и хлора. Неустойчивы, а иногда огнеопасны и взрывчаты соединения цезия с азотом, бором, кремнием и германием. Галогениды и соли большинства кислот более стабильны.
Соединения с кислородом. Цезий образует девять соединений с кислородом, имеющих состав от Cs7O до CsO3.
Оксид цезия Cs2O образует коричнево-красные кристаллы, расплывающиеся на воздухе. Его получают медленным окислением недостаточным (2/3 от стехиометрического) количеством кислорода. Остаток непрореагировавшего цезия отгоняют в вакууме при 180–200° С. Оксид цезия в вакууме при 350–450° С возгоняется, а при 500° С разлагается:
2Cs2O = Cs2O2 + 2Cs
Энергично реагирует с водой, давая гидроксид цезия.
Оксид цезия является компонентом сложных фотокатодов, специальных стекол и катализаторов. Установлено, что при получении синтола (синтетической нефти) из водяного газа и стирола из этилбензола, а также при некоторых других синтезах добавление к катализатору незначительного количества оксида цезия (вместо оксида калия) повышает выход конечного продукта и улучшает условия процесса.
Гигроскопичные бледно-желтые кристаллы пероксида цезия Cs2O2 можно получить окислением цезия (или его раствора в жидком аммиаке) дозированным количеством кислорода. Выше 650° С пероксид цезия разлагается с выделением атомарного кислорода и энергично окисляет никель, серебро, платину и золото. Пероксид цезия растворяется в ледяной воде без разложения, а выше 25° С реагирует с ней:
2Cs2O2 + 2H2O = 4CsOH + O2
В кислотах он растворяется с образованием пероксида водорода.
При сжигании цезия на воздухе или в кислороде образуется золотисто-коричневый надпероксид цезия CsO2. Выше 350° С он диссоциирует с выделением кислорода. Надпероксид цезия – очень сильный окислитель.
Пероксид и надпероксид цезия служат источниками кислорода и используются для его регенерации в космических и подводных кораблях.
Полуторный оксид «Cs2О3» образуется в виде темного парамагнитного порошка при осторожном термическом разложении надпероксида цезия. Его можно также получить окислением металла, растворенного в жидком аммиаке, или контролируемым окислением пероксида. Предполагается, что он является динадпероксидом-пероксидом [(Cs+)4(O22–)(O2–)2].
Оранжево-красный озонид CsО3 можно получить при действии озона на безводный порошок гидроксида или пероксида цезия при низкой температуре. При стоянии озонид медленно разлагается на кислород и надпероксид, а при гидролизе он сразу превращается в гидроксид.
Цезий образует также субоксиды, в которых формальная степень окисления элемента существенно ниже +1. Оксид состава Cs7O имеет бронзовую окраску, его температура плавления равна 4,3° С, активно реагирует с кислородом и водой. В последнем случае образуется гидроксид цезия. При медленном нагревании Cs7O разлагается на Cs3O и цезий. Фиолетовые кристаллы Cs11O3 плавятся с разложением при 52,5° С. Красно-фиолетовый Cs4O разлагается выше 10,5° С. Нестехиометрическая фаза Cs2+xO меняет состав вплоть до Cs3O, который разлагается при 166° С.
Гидроксид цезия CsOH образует бесцветные кристаллы, которые плавятся при ° С. Температуры плавления гидратов еще ниже, например моногидрат CsOH·H2O плавится с разложением при 2,5° С, а тригидрат CsOH·3H2O – даже –5,5° С.
Гидроксид цезия служит катализатором синтеза муравьиной кислоты. С этим катализатором реакция идет при 300° С без высокого давления. Выход конечного продукта очень велик – 91,5%.
Галогениды цезия CsF, CsCl, CsBr, CsI (бесцветные кристаллы) плавятся без разложения, выше температуры плавления летучи. Термическая устойчивость понижается при переходе от фторида к иодиду; бромид и иодид в парах частично разлагаются на простые вещества. Галогениды цезия хорошо растворимы в воде. В 100 г воды при 25° С растворяется 530 г фторида цезия, 191,8 г хлорида цезия, 123,5 г бромида цезия, 85,6 г иодида цезия. Из водных растворов кристаллизуются безводные хлорид, бромид и иодид. Фторид цезия выделяется в виде кристаллогидратов состава CsF·nH2O, где n = 1, 1,5, 3.
При взаимодействии с галогенидами многих элементов галогениды цезия легко образуют комплексные соединения. Некоторые из них, например Cs3[Sb2Cl6], используют для выделения и аналитического определения цезия.
Фторид цезия применяют для получения фторорганических соединений, пьезоэлектрической керамики, специальных стекол. Хлорид цезия – электролит в топливных элементах, флюс при сварке молибдена.
Бромид и иодид цезия широко используются в оптике и электротехнике. Кристаллы этих соединений прозрачны для инфракрасных лучей с длиной волны от 15 до 30 мкм (CsBr) и от 24 до 54 мкм (CsI). Обычные призмы из хлорида натрия пропускают лучи с длиной волны 14 мкм, а из хлорида калия – 25 мкм, поэтому применение бромида и иодида цезия вместо хлоридов натрия и калия сделало возможным снятие спектров сложных молекул в отдаленной инфракрасной области.
Если при изготовлении флуоресцирующих экранов для телевизоров и научной аппаратуры ввести между кристалликами сульфида цинка примерно 20% иодида цезия, экраны будут лучше поглощать рентгеновские лучи и ярче светиться при облучении электронным пучком.
Сцинтилляционные приборы для регистрации тяжелых заряженных частиц, содержащие монокристаллы иодида цезия, активированного таллием, обладают наибольшей чувствительностью из всех приборов подобного назначения.
Цезий-137.
Изотоп 137Cs образуется во всех атомных реакторах (в среднем 6 ядер 137Cs из 100 ядер урана).
При нормальных условиях эксплуатации АЭС выбросы радионуклидов, в том числе радиоактивного цезия, незначительны. Подавляющее количество продуктов ядерного деления остается в топливе. По данным дозиметрического контроля, концентрация цезия в районах расположения АЭС почти не превышает концентрацию этого нуклида в контрольных районах.
Сложные ситуации возникают после аварий, когда во внешнюю среду поступает огромное количество радионуклидов и загрязнению подвергаются большие территории. Поступление цезия-137 в атмосферу было отмечено при аварии на Южном Урале в 1957 г., где произошел тепловой взрыв хранилища радиоактивных отходов, при пожаре на радиохимическом заводе в Уинденейле в Великобритании в 1957, при ветровом выносе радионуклидов из поймы оз. Карачай на Южном Урале в 1967. Катастрофой стала авария на Чернобыльской атомной электростанции в 1986, на долю цезия-137 пришлось около 15% общего радиационного заражения. Основной источник поступления радиоактивного цезия в организм человека – загрязненные нуклидом продукты питания животного происхождения.
Радионуклид 137Cs можно использовать и с пользой для человека. Он применяется в дефектоскопии, а также в медицине для диагностики и лечения. Цезием-137 заинтересовались специалисты в области рентгенотерапии. Этот изотоп разлагается сравнительно медленно, теряя за год только 2,4% своей исходной активности. Он оказался пригодным для лечения злокачественных опухолей. Цезий-137 имеет определенные преимущества перед радиоактивным кобальтом-60: более длительный период полураспада и менее жесткое g-излучение. В связи с этим приборы на основе 137Cs долговечнее, а защита от излучения менее громоздка. Однако, эти преимущества становятся реальными лишь при отсутствии примеси 134Cs с более коротким периодом полураспада и более жестким g -излучением.
Из растворов, полученных при переработке радиоактивных отходов ядерных реакторов, 137Cs извлекается методами соосаждения с гексацианоферратами железа, никеля, цинка или фторовольфраматом аммония. Используют также ионный обмен и экстракцию.
Елена Савинкина
www.krugosvet.ru
металл — Русский-Чешский Словарь — Glosbe
ru У этого металла есть чувства.
OpenSubtitles2018.v3cs Ten kov vnímá vnější vlivy.ru Это металл с Татуина!
OpenSubtitles2018.v3cs To je Tatooinský kov!ru Ага, видишь небольшой кусочек металла вот тут?
OpenSubtitles2018.v3cs Jo, ale vidíš tam ten kousek kovu?ru Это маленькие кусочки металла, которые откололись от импланта.
OpenSubtitles2018.v3cs Drobné kousky kovu, odlomené z implantátu.ru 5 Золота и серебра, которое находится в царской сокровищнице, не хватает, чтобы заплатить эту дань, поэтому Езекия забирает все ценные металлы, какие только можно забрать, из храма.
JW_2017_12cs 5 V královské pokladnici však na zaplacení tributu není dost zlata a stříbra, a proto Ezekjáš získává co možná nejvíce drahých kovů z chrámu.ru Железо — полезный металл.
tatoebacs Železo je užitečný kov.ru Токсичные тяжёлые металлы могли вызывать рвоту.
OpenSubtitles2018.v3cs Otrava těžkým kovem mohla způsobit zvracení.ru Это… кусочек металла.
OpenSubtitles2018.v3cs Je to… kousek kovu.ru Нам нужно… больше металла.
OpenSubtitles2018.v3cs Potřebuje to víc metalu.ru Люди и инопланетяне, внутри 2500000 тонн вращающегося металла, в полном одиночестве в ночи.
OpenSubtitles2018.v3cs Pozemšťané a mimozemšťané, spolu ve dvou a půl miliónu tunách kovu rotujícího a osamoceného v tmavém a nekonečném prostoru.ru И мне потребуются эти ножницы по металлу, которые похожи на обычные, но намного мощнее.
OpenSubtitles2018.v3cs A taky tyhle ty nůžky na plech, které jsou jako obyčejné nůžky, jen silnější.ru Ладно, ты же знаешь, что нам придется сидеть на скамейках из холодного металла, так?
OpenSubtitles2018.v3cs Ok, ale víš, že budeme sedět na studené a kovové nekryté tribuně?ru Остальные металлы ведут себя подобным образом.
JW_2017_12cs Jiné kovy se chovají stejně.ru Это когда кусочки металла соединяются вместе.
OpenSubtitles2018.v3cs Když spojuješ kousky železa k sobě.ru Металлы, в отличие от керамики, со временем минерализуются.
OpenSubtitles2018.v3cs Kovy, narozdíl od keramiky, v průběhu času mineralizují.ru Например, каждый день миллионы людей мчатся на высокой скорости, заключённые в тонну металла, и они едут рядом с другими, которые делают то же самое.
ProjectSyndicatecs Miliony lidí například dennodenně uhánějí vysokou rychlostí v tuně kovu, a to v naprosté blízkosti dalších lidí, kteří dělají totéž.ru Они не могут посвятить всю жизнь металлу и моторам.
OpenSubtitles2018.v3cs Nemohou jen tak věnovat celé své životy kovům a motorům.ru Медь — блестящий, важный для жизни, металл.
OpenSubtitles2018.v3cs Měď je lesklý kov, nezbytný pro život.ru Черито. 3 раза подбирался к хранилищу драгоценных металлов.
OpenSubtitles2018.v3cs Cheritto projel třikrát kolem trezoru s vzácnými kovy.ru Изделия из обычных металлов художественные
tmClasscs Umělecká díla z běžných kovůru Ни стекла, ни обломков металла, ничего.
OpenSubtitles2018.v3cs Žádné střepy, kovové částečky, nic.ru Их металл крепче и лучше нашего.
OpenSubtitles2018.v3cs Jejich železo je pevnější a lepší než naše.ru Бедной девочке прилетело три осколка металла в сердце, когда грузовик с ломом врезался в ее машину.
OpenSubtitles2018.v3cs Ta chuděra schytala tři střepiny do srdce, když do ní narazilo auto z vrakoviště.ru Это, вроде как, один из самых твердых металлов.
OpenSubtitles2018.v3cs To je jeden z nejsilnějších kovů vůbec.ru Закалка металлов
tmClasscs Popouštění kovůru.glosbe.com
Металл, Cs, 5 букв
Случайный анекдот:
Письмо семьи реднеков сыну. (реднек — это житель южных штатов США).
Любимейший мой сынок-реднек!
Я пишу очень медленно, так как знаю, что ты не можешь читать быстро.
Мы уже не живем там, где мы жили до того, как ты уехал от нас. Твой папа
прочел в газете, что большинство аварий случаются в 20-ти милях от дома,
и мы переехали подальше.
А не могу послать тебе свой адрес, так как последняя семью из Арканзаса,
которая тут жила до нас, забрала с собой все номера домов, чтобы им не
менять адреса.
Дом у нас хороший. Тут даже есть стиральная машина. Я, правда, не
уверена, что она нормально работает: на прошлой неделе я заложила в
стирку белье, и потянула за цепочку. С тех пор мы белья больше не
видали.
Погода здесь ничего. Дождь был только два раза на прошлой неделе; первый
раз он шел три дня, и второй — четыре.
Да, по поводу того пальто, что ты хотел, чтобы я тебе послала: твой дядя
Билли Боб сказал, что с пуговицами оно будет очень тяжелым для посылки
почтой, так что мы спороли пуговицы и положили их в карманы пальто.
Бубба вчера запер в машине свои ключи; мы очень переволновались, потому
что ему понадобилось два часа, чтобы вытащить меня и папу из машины.
Твоя сестра родила этим утром, но я еще не знаю, кто у нее, поэтому не
могу тебе сказать, ты теперь дядя или тетя.
Дядя Бобби Рэй упал в бочку виски на прошлой неделе. Мужики пытались его
вытащить, но он отбился от них и утонул. Мы его кремировали: он горел
три дня.
Три твоих друга упали с моста в своем грузовичке. Бутч был за рулем. Он
открыл окно и выплыл. Двое других были в кузове. Они утонули, потому что
не смогли опустить задний борт, чтобы выйти.
Больше пока писать не о чем. Ничего особенного, как видишь, у нас не
произолшо.
Твоя любимая тетя, Мама.
scanword.org

 Особенности химических свойств s-элементов I группы и их физиологическое действие
Особенности химических свойств s-элементов I группы и их физиологическое действие