Таблица Менделеева для чайников – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
Периодическая система химических элементов Д. И. МенделееваНа первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов.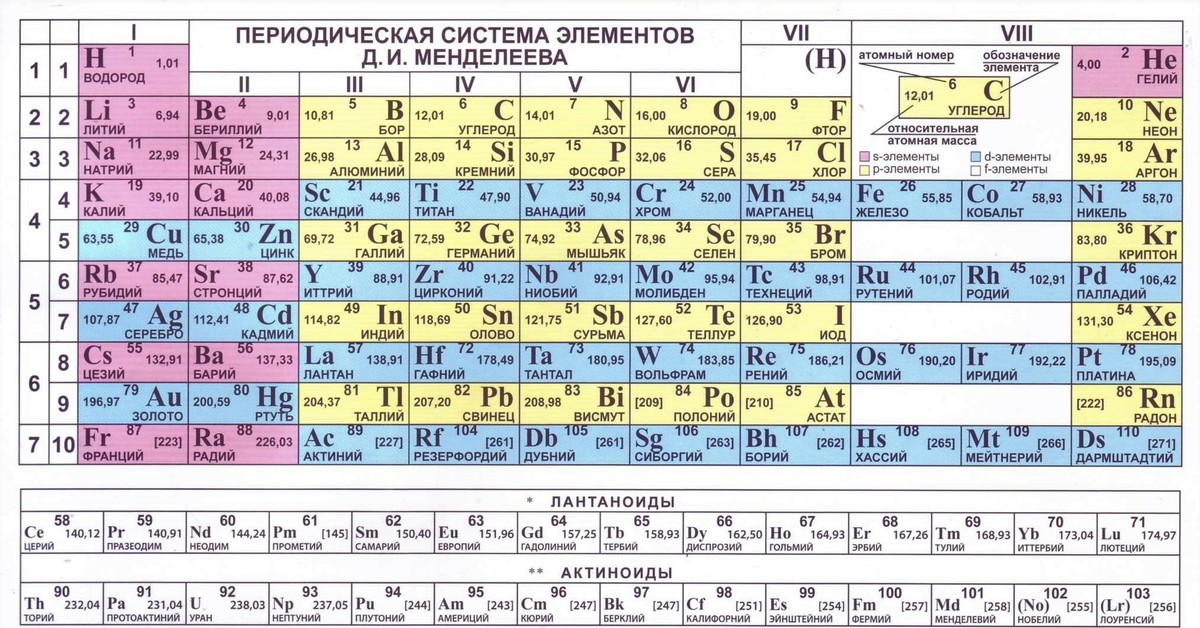 Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.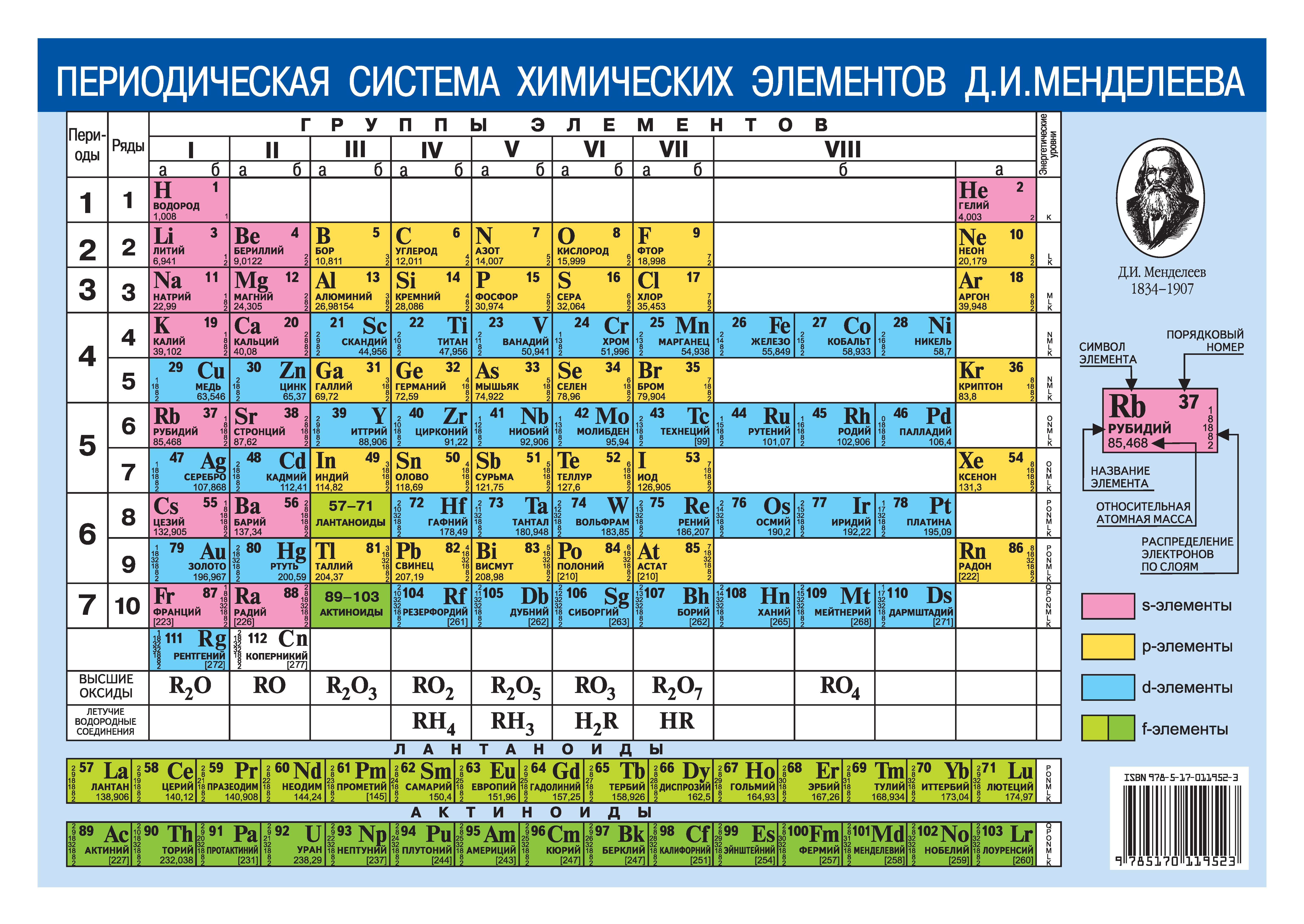 Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Школьники узнали секреты таблицы Менделеева на Всероссийском открытом уроке по химии
7 февраля прошел Всероссийский открытый урок «Менделеев? Элементарно!». Мероприятие, организованное Министерством просвещения РФ совместно с порталом «ПроеКТОриЯ», было посвящено Международному году Периодической таблицы химических элементов Д.И. Менделеева.
Во время урока ребята познакомились с человеком-легендой Юрием Оганесяном. В честь Юрия Цолаковича назван 118-ый химический элемент периодической таблицы — оганесон. Научный руководитель лаборатории ядерных реакций им. Г.Н. Флёрова Объединенного института ядерных исследований в Дубне объяснил зрителям, как получают новые элементы и отметил значимость открытия Менделеева: «Меня часто спрашивают: „Периодический закон на самом деле такой фундаментальный?“. Да! Природа создавала всё другим способом, мы это делаем в лаборатории тоже другим. Но если это атом, он должен быть сконструирован по вполне определенному закону. Именно по этому знаменитому Периодическому закону, которому сегодня исполняется 150 лет».
Научный руководитель лаборатории ядерных реакций им. Г.Н. Флёрова Объединенного института ядерных исследований в Дубне объяснил зрителям, как получают новые элементы и отметил значимость открытия Менделеева: «Меня часто спрашивают: „Периодический закон на самом деле такой фундаментальный?“. Да! Природа создавала всё другим способом, мы это делаем в лаборатории тоже другим. Но если это атом, он должен быть сконструирован по вполне определенному закону. Именно по этому знаменитому Периодическому закону, которому сегодня исполняется 150 лет».
Специальным гостем урока стал Григорий Трубников, первый заместитель Министра науки и высшего образования РФ. Он рассказал школьникам, кто такой — современный учёный:
«Это очень разносторонние люди: и в литературе, и в музыке, и в языках. Но самая главная черта, которая движет ученым — быть первым там, где никто никогда не был». И пригласил ребят в науку, потому что мы знаем об окружающем мире лишь 4% тайн природы.
Вице-президент Российского химического общества им. Д.И. Менделеева Юлия Горбунова
«Гениальность заключается в том, что Дмитрий Иванович не просто объединил их по сходству свойств, а ещё и предсказал появление новых элементов. И на сегодняшний день 118 элементов располагаются по той самой структуре, которую придумал Менделеев».
Спикеры уделили внимание и самой сложной биохимической лаборатории — человеку. Степан Калмыков, декан химического факультета МГУ им. М.В.Ломоносова поделился с аудиторией «формулами» любви, рассказал, какие вещества отвечают за наши эмоции, и развеял миф о том, что хорошее образование можно получить только в столице.
«У нас появилось много хороших университетов не только в Москве и Санкт-Петербурге. Качественное образование вы можете получить далеко за их пределами — в Тюмени, Новосибирске, Красноярске, Томске», — добавил Степан Николаевич.
О новых материалах в современном протезировании рассказал научный сотрудник Центра композиционных материалов НИТУ «МИСиС» Фёдор Сенатов. Школьники из Тобольска поинтересовались, можно ли печатать элементы костной ткани на 3D-принтере и как быстро эта технология распространится по стране.
«Аддитивные технологии огромными шагами двигаются по всей России. Хорошие 3D-принтеры, способные напечатать костную ткань, есть во многих городах. Просто у каждого своя задача: можно печатать металлами, а можно — целыми клетками. Эти технологии есть, они активно развиваются, и это наше будущее», — ответил Фёдор.
Прямая трансляция урока была организована на портале «ПроеКТОриЯ» и в группах проекта в социальных сетях ВКонтакте и Одноклассники. К эфиру из Центра прототипирования высокой сложности «Кинетика» НИТУ «МИСиС» в режиме телемоста подключились ребята из Тобольска (родина Д.И.Менделеева), Чебоксар, Новокузнецка и Тюмени.
В конце урока модератор, известный теле—, радиоведущий Антон Комолов предложил педагогам и школьникам стать соавторами следующих открытых уроков и записать видео для рубрик «Просто о сложном» и «Поставь вопросом в тупик». А также объявил старт опроса «Кто из известных людей увлекался химией?». Правильные ответы зрители смогут узнать в группах «ПроеКТОрии» в социальных сетях.
Следующий Всероссийский открытый урок состоится 21 февраля в 13:00 (мск) и будет посвящен градостроению и умным городам.
Электронные образовательные ресурсы (ЭОР)
Начальный курс химии:http://www.alhimik.ru/teleclass/glava1/gl-1-0.shtml
ВНО — 2017 на Яндексе https://zno.yandex.ua/ru/chemistry/
АЛХИМИК http://www.alhimik.ru/ Программы школьного и вузовского курса химии, методические находки, вести из мира дистанционного образования, анонсы новых книг. Интернет-класс (начальный курс химии), химическая кунсткамера, читальный зал, виртуальный консультант, электронные учебные пособия по курсу неорганической химии, задачник, практикум, химический справочник, методические статьи, химия на каждый день: в саду, на кухне, наука о чистоте, домашняя аптечка, косметика, домашний мастер, экология дома. «Химическая всячина»: полезные ссылки, ответы на вопросы. Химические новости. Веселая химия.
«Химическая всячина»: полезные ссылки, ответы на вопросы. Химические новости. Веселая химия.
Журнал «Химия и химики»http://chemistry-chemists.com/
Дистанционные курсы при МГУ для подготовки абитуриентовhttp://do.chem.msu.ru/rus/abitur/dl/
Виртуальная химическая школа http://maratakm.narod.ru/
Портал «Сеть творческих учителей» http://it-n.ru/default.aspx
Сообщество взаимопомощи учителей. Химия http://pedsovet.su/load/97
Газета «Химия» и сайт для учителя «Я иду на урок химии» http://him.1september.ru/
WebElements: онлайн-справочник химических элементов http://webelements.narod.ru/
Химия для всех: иллюстрированные материалы по общей, органической и неорганической химии
http://school-sector.relarn.ru/nsm/
Химический справочник http://tehtab.ru/Guide/GuideChemistry/
Chemnet — портал фундаментального химического образования России http://www.chemnet.ru
Химия: открытый колледж http://college.ru/chemistry/ (Интерактивный курс химии, включающий учебник, большое количество моделей и демонстраций, справочные материалы, тестирование, обратную связь с учениками).
Химия для всех. Серия «Обучающие энциклопедии» http://www.informika.ru/text/database/chemy/START.html Разделы: общая химия, неорганическая химия, органическая химия, тесты, справочные материалы, стереомодели молекул.
Химия для всех. Электронный учебник
http://school-sector.relarn.ru/nsm/chemistry/Rus/chemy.html Иллюстрированные материалы по разделам: общая, органическая и неорганическая химия. Справочник, Тесты, видео (демо).
Органическая химия. Электронный учебник для средней школы.http://cnit.ssau.ru/organics/index.htm:
Нобелевские лауреаты по химии http://n-t.ru/nl/hm/ Биографический электронный справочник, снабженный гиперссылками, списками литературы.
Этимология химических элементов http://www.biochem.nm.ru/science/element.htmНазвания химических элементов — связь со свойствами, географическими и астрономическими объектами, учеными, мифологическими персонажами. В разделе история химии все великие открытия, биографические очерки о великих химиках различных времен, интерактивные ссылки, иллюстрации.
Элементы жизни http://school2.kubannet.ru/. Сайт можно использовать как пособие для уроков химии в школе и дополнительном образовании.
Сайт о химии XuMuK.ru http://www.xumuk.ru/?_openstat=ZGlyZWN0LnlhbmRleC5ydTs4Njcw Химические справочники, энциклопедии, статьи.
Химический раздел http://www.websib.ru/noos/chemistry/cheerful.htm Интересный сайт, на котором собраны материалы для учителей и учеников. Разделы сайта: Программы; Органическая химия; Учительская; ХимSoft; Из истории; Это интересно; Советы химикам; Веселые химики; Химия и жизнь; Абитуриенту; Книги, журналы, статьи; Химические ресурсы.
Дистанционное обучение по химии http://chem.olymp.mioo.ru/ Сайт химического факультета Московского государственного университета. Среди материалов сайта особый интерес представляют разделы: Консультации по химии для школьников; Консультации для учителей химии. Кроме того представлены материалы для подготовки к олимпиаде по химии. Имеются материалы для подготовки к поступлению в вузы.
КонТрен — Химия для всех http://kontren.narod.ru/ Сайт химического факультета Тюменского государственного университета. Учебно-информационный сайт, предназначенный для студентов химических факультетов, учителей химии, школьников и абитуриентов.
Химия. Образовательный сайт для школьников http://www.hemi.nsu.ru/ Очень хороший сайт по химии, с подробным изложением различных ее разделов. Полезен не только для школьников, но и для студентов (возможно, и для преподавателей). Все хорошо оформлено, много ссылок. Иллюстрации, словарь терминов, задачи, периодическая система Менделеева и т.д. Постоянно обновляется.
HimHelp.ru: химический сервер http://www.himhelp.ru/ Полный курс химии: теоретические основы, неорганическая и органическая химия. Информация о великих ученых. Многофункциональная периодическая система элементов Д. И. Менделеева, химический калькулятор. Новости.
Школьная химия http://schoolchemistry.by.ru/ Истории возникновения химии, события и хронология. Материалы для учащихся: рефераты, химический калькулятор, сборник упражнений и задач, тесты по химии.
Химия: пособие для абитуриентов http://chemi.org.ru/ Материалы по основам неорганической и органической химии. Словарь, биография ученых, каталог полезных сайтов и форум.
Занимательная химия: проект по методике преподавания химии. http://home.uic.tula.ru/~zanchem/Материалы сайта: интересные опыты, химические истории и курьёзы, рассказы о великих учёных-химиках и др. Электронная версия таблицы Менделеева. Большое количество материала, имеется поиск по сайту, особый интерес представляет раздел «полезные ссылки», в котором представлены адреса наиболее информативных сайтов по химии.
Справочник по химии для школьников.http://www.chemworld.narod.ru/referance.html Таблица атомных свойств химических элементов. Электронный вариант таблицы Д.И. Менделеева. Краткий химический словарь. Таблица растворимости кислот, щелочей и оснований. Биографии известных химиков. Тривиальные названия некоторых веществ.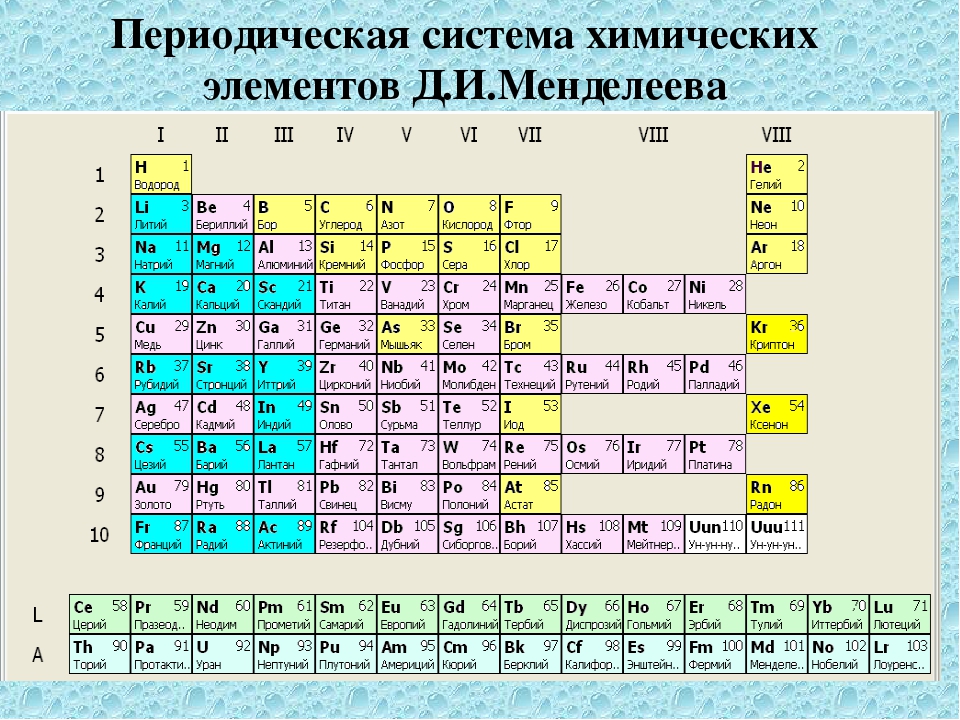
Галерея великих химиков http://www.chemnet.ru/zorkii/istkhim/veliki1.htm Портреты и краткие биографические справки о 48 выдающихся химиках мира.
Всё о химии: методические и дидактические материалы http://www.chemistry-43school.narod.ru/Тренировочные и проверочные задания по химии для 8-11 классов; программа подготовки к экзаменам по химии, материалы ЕГЭ; творческие и занимательные задания; решения задач повышенной сложности. Материалы о жизни и открытиях великих ученых в области химии; тематические новости. Ссылки на образовательные ресурсы.
Электронная библиотека по химии и технике http://rushim.ru/books/books.htmКоллекция электронных версий учебников, учебных пособий, научных статьей, задачников, журналов, справочников, нормативных документов и инструкций по всем разделам химии.
Учебное пособие «Краткий очерк истории химии» http://www.physchem.chimfak.rsu.ru/Source/History/big_index.html Интерактивный учебник с большим количеством приложений, слайдами для презентаций и вопросами для самопроверки.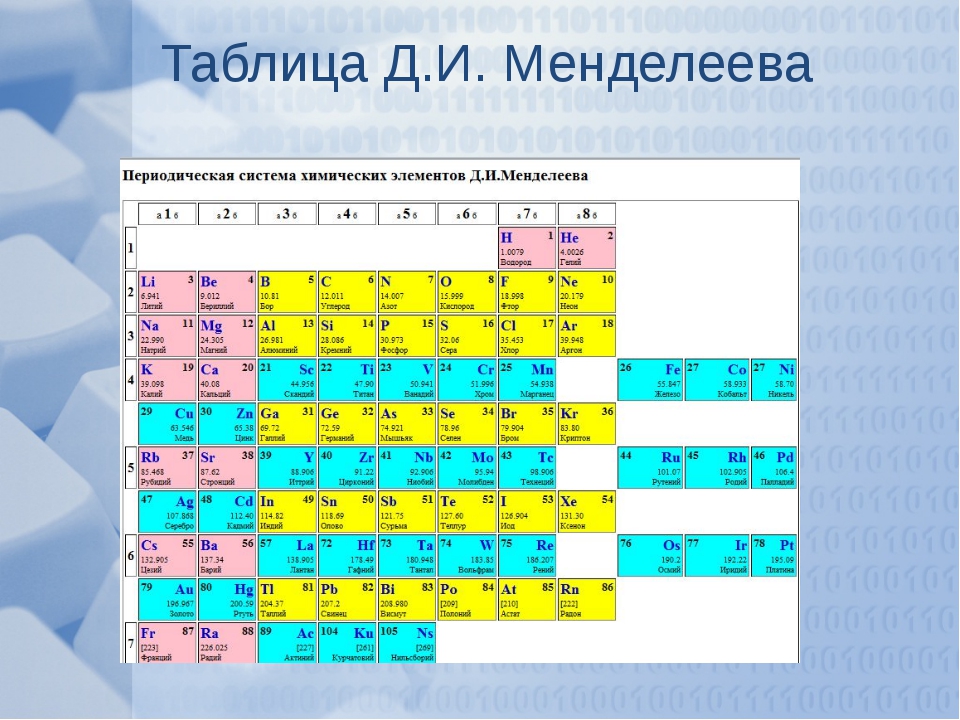 Биографии и портреты известных химиков в алфавитном порядке. Приложения и дополнения (статьи, исторические факты; химические схемы и таблицы).
Биографии и портреты известных химиков в алфавитном порядке. Приложения и дополнения (статьи, исторические факты; химические схемы и таблицы).
Таблицу Менделеева хотят расширить до 173 элементов
Последний химический элемент таблицы Менделеева сегодня имеет номер 118. Речь об элементе под названием оганесон. Но расчёты физиков и химиков указывают на то, что мы вполне можем получить 173 элемента. Как это реализовать, ученые обсуждают в Дубне на международном совещании «Сверхтяжелые элементы». В дискуссии участвуют президент РАН Александр Сергеев и члены Совета РАН по физике тяжелых ионов.
Совещание проходит в Дубне, так как именно здесь, в Лаборатории ядерных реакций Объединенного института ядерных исследований, впервые в мире был синтезирован тот самый «конечный» 118-й элемент, а также пятерка других – со 113-го по 117-й.
Кстати, элемент под номером 118 назван оганесоном в честь академика Юрия Оганесяна, научного руководителя Лаборатории ядерных реакций. Его команда создала все шесть сверхтяжелых химических элементов от номера 113 до номера 118.
Его команда создала все шесть сверхтяжелых химических элементов от номера 113 до номера 118.
Известный на весь мир советский и российский учёный Юрий Цолакович Оганесян. Сейчас академику 88 лет.
Как дополнить Природу своими рукамиЧеловечество в лице великих ученых еще в начале ХХ века пришло к выводу, что химические элементы можно не только находить в природе, но и создавать искусственно.
Первым «искусственным» элементом стал технеций, стоящий в таблице Менделеева под номером 43. Его синтезировали в 1937 году, а впоследствии обнаружили в ничтожных количествах в природе.
Сверхтяжелых элементов с номерами от 95-го до 118-го в природе не существует. Да и в стенах лаборатории сверхтяжелые элементы живут доли секунды.
Жизнь таких элементов столь коротка из-за их супертяжелых ядер, в которых в невероятной тесноте обитают почти три сотни протонов и нейтронов.
Напомним, что из протонов и нейтронов состоят ядра всех химических элементов.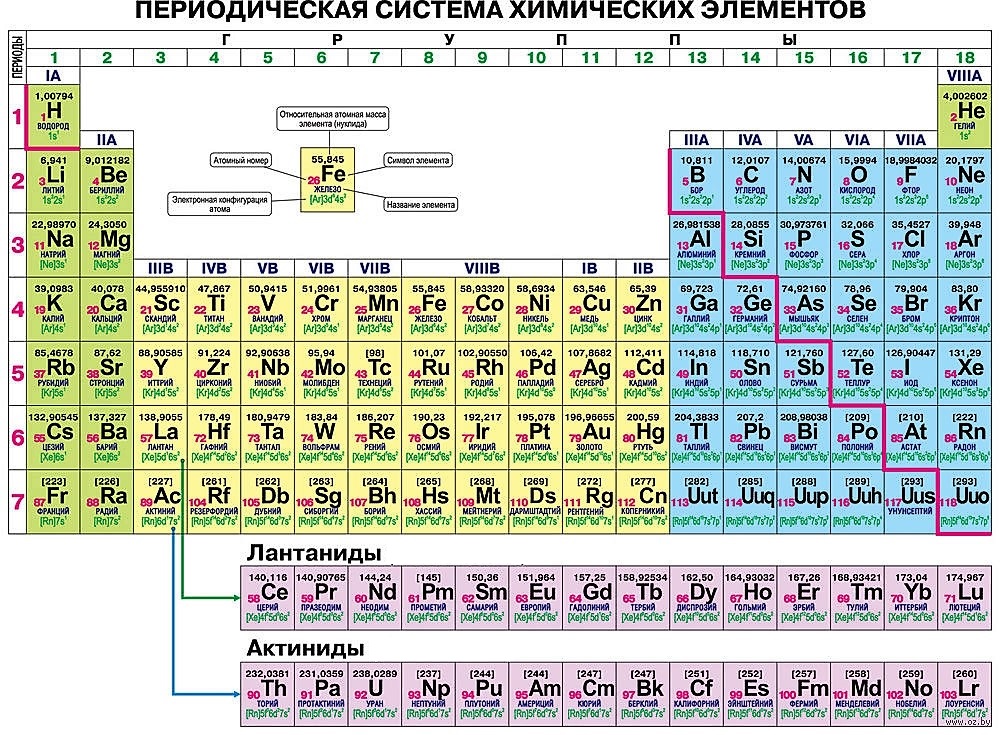 Но, чем больше в ядре протонов и нейтронов, тем сильнее взаимодействия между ними – как в толпе вагона метро.
Но, чем больше в ядре протонов и нейтронов, тем сильнее взаимодействия между ними – как в толпе вагона метро.
Подобно выскакивающим из набитого вагона пассажирам, из переполненного ядра всякого сверхтяжелого элемента с облегчением вылетает на волю компания из двух протонов и двух нейтронов – альфа-частица. Так сверхтяжелый элемент превращается в более легкий и «жизнеспособный». Этот процесс физики называют альфа-распадом.
Таким образом, все сверхтяжелые элементы радиоактивны. И это объясняет, почему сверхтяжелых элементов нет в природе. Даже если они и образуются где-то в естественных условиях, человечество их попросту не может «поймать».
Так что синтез сверхтяжелых элементов сравним с актом творения Природы. Это сверхзадача, которая удивительным образом оказалась под силу человеку – его мысли и его технологиям.
Временная шкала показывает, когда открывались те или иные элементы. Перевод Вести.Ru.
Есть ли пределы у Природы?Создатели сверхтяжелых элементов, конечно, думали над вопросом, какое максимальное число протонов и нейтронов можно объединить в ядро и окружить облаком из электронов, чтобы такую конструкцию можно было назвать химическим элементом.
Четыре года назад группа новозеландских и американских физиков заявила: на оганесоне таблица Менделеева закончилась, и химическим элементам с номерами 119 и 120 уже не бывать.
Однако более поздние расчеты французских, шведских, польских, финских специалистов показали, что на оганесоне таблица Менделеева не закончится. Номер последнего элемента таблицы Менделеева – 173!
До него, конечно, еще нужно добраться, но дубненским физикам технология их создания уже понятна.
Для синтеза элементов выше 118-го в Объединенном институте ядерных исследований недавно построили «Фабрику сверхтяжелых элементов». Там собираются начать синтез химических элементов под номерами 119 и 120 осенью 2021 года.
Куда применить сверхтяжелые элементы?Сверхтяжелые элементы могут стать волшебным инструментом получения частиц из пустоты, то есть из вакуума. Осуществить эту известную идею в Дубне на коллайдере NICA предложил 30 июня академик Юрий Оганесян. Коллайдер сейчас строится в Дубне и должен войти в строй через два года.
Коллайдер сейчас строится в Дубне и должен войти в строй через два года.
Согласно физической теории, сильное электрическое поле может рождать в вакууме пару двух частиц – электрон и позитрон. Позитрон – это античастица для электрона. Он всем похож на электрон, только заряжен положительно.
Еще никому в мире не удалось получить электрон-позитронную пару из вакуума с помощью электрического поля.
Но коллайдер NICA будет способен ускорять тяжелые ядра урана. В ядре урана 92 протона. При сближении двух тяжелых ядер урана возникает очень сильное электрическое поле. Его создают заряды обоих ядер. Это сильное поле должно рождать в вакууме пару двух элементарных частиц – электрон и позитрон.
Что при этом будет происходить? Один протон из ядра урана будет забирать рожденный из вакуума электрон и превращаться вместе с ним в нейтрон. После этого в ядре урана останется 91 протон, а нейтронов станет на один больше.
Позитрон же улетит восвояси. Его «увидит» детектор, после чего физики сообщат миру о фундаментальном событии – рождении электрон-позитронной пары из вакуума с помощью электрического поля. Такое вот волшебство.
Такое вот волшебство.
Второй вариант вынашивания и рождения электрон-позитронной пары из вакуума: создание сильного электрического поля с помощью мощного лазера.
Период полураспада сверхтяжелых элементов исчисляется долями секунд. Перевод Вести.Ru.
Президент РАН Александр Сергеев в ходе своего доклада перед участниками совещания дополнил перечень новых физических явлений, которые можно будет получить на российских установках с помощью такого лазера. Также академик озвучил необходимые параметры такого инструмента.
К примеру, для рождения электрон-позитронной пары понадобится петаваттный лазер, то есть лазер мощностью 10-100 петаватт. Один петаватт равен 1015 Вт.
Лазерный центр такой выдающейся мощности для ядерно-физических исследований академик Сергеев предложил построить в Дубне. Его созданием инженеры займутся после завершения строительства коллайдера NICA.
Ранее мы сообщали о создании физиками новой периодической системы химических элементов, отражающей законы ядерной физики, а не химии.
Больше новостей из мира науки вы найдёте в разделе «Наука» на медиаплатформе «Смотрим».
Середина урока 34 мин | 3 мин 1 мин 10 мин 1 мин 14 мин 3 мин 5мин | Прием «Ассоциация». Учащимся предлагается просмотреть картинки: — О чем может пойти речь на уроке? — Какая ассоциация у вас возникла после просмотра картинок?…(наводящие вопросы) Учащиеся перечисляют все возникшие ассоциации. которые учитель записывает на доске, после чего определяют тему урока. Дескриптор:
ФО: похвала Метод «Мозговой штурм». — Почему таблицу химических элементов называют периодической? Метод: «Джигсо». Задание: Учащиеся читают текст в учебнике и дополнительно в интернете, обсуждают в группе. Индивидуальная и групповая работа. Дескриптор
ФО: Поддержание диалога и оказание поддержки. Разминка. Танец по видеролику: «Танцующий бобер». Метод: «Диаграмма Вена» (тройная диаграмма). /Сборник ФО/ Групповая работа на флипчарте. Задание: Сравните классификации элементов И.Дёберейнера, Дж. Ньюлендса, Д.И. Менделеева, выявите сходство и различие. Учитель задает наводящие вопросы. А – Триады И.Доберейнера В – Октавы Дж.Ньюлендса С – Периодическая таблица Д.И.Менделеева Вывод: Вклад И. Доберейнера_________________________ Вклад Дж.Ньюлендса _________________________ Вклад Д.И. Менделеева _______________________ Дескриптор:
ФО: взаимооценивание групп Метод: «Выдели самое важное». Задание: — Как вы думаете, что является самым важным в изученной сегодня теме? Какая информация была самой важной? Почему вы так считаете?… Дескриптор:
ФО: смайлики Метод: «Сделай выбор». Индивидуальная работа. Уровневые задания : №1. Выпишите отдельно металлы, неметаллы: Fe, AI, P, C, S, Cu, Ca, CI, O, N, Na. №2 . Расположите элементы в порядке возрастания атомных весов: O, F, N ,C ,B ,Li,Be, H ,He, Ne. №3 Выявите в рядах соединений правильное расположение в соответствие свойств от основных к кислотным: 1) SiО2, Na2O, SO2 , MgO 3) Na2O, MgO, SiО2, SO2 3) Li2O, BeO, CO2 , N2O5 4) N2O5, BeO ,Li2O, CO2 5) NaOH, h4PO4, Ca(OH)2, h3SO4 6) NaOH, Ca(OH)2, h4PO4, h3SO4 Дополнительные задание. В задании №3 выпишите отдельно формулыосновныхи кислотных оксидов, оснований и кислот. Дескриптор:
ФО: взаимооценивание в группах по ключу (по часовой стрелке). | ИКТ Периодическая таблица, картинки Раздаточный материал, учебники Флипчарт, маркеры, учебник Текст в учебнике Задания на карточке или интерактив-ной доске (ключи ответов) |
Полная таблица Менделеева — «Виртуальная Академия»
Таблица Менделеева представляет собой классификацию химических элементов, устанавливающую зависимость свойств элементов от заряда атомного ядра. Периодическая система химических элементов – это графическое выражение периодического закона, который установил великий русский химик в 1869 году. Было предложено огромное количество вариантов изображения периодической системы, однако в современном варианте полная таблица Менделеева является двумерной, и в ней столбцы определяют основные физико-химические свойства, а строки представляют собой подобные друг другу периоды.
Периодическая система химических элементов – это графическое выражение периодического закона, который установил великий русский химик в 1869 году. Было предложено огромное количество вариантов изображения периодической системы, однако в современном варианте полная таблица Менделеева является двумерной, и в ней столбцы определяют основные физико-химические свойства, а строки представляют собой подобные друг другу периоды.
Как гласит легенда, мысль о создании системы химических элементов пришла к ученому во сне, после чего Менеделеев написал на карточках основные свойства каждого элемента (в то время их было известно 63). Многократно переставляя эти карточки, составляя из них ряды элементов, сходных по своим свойствам, великий химик сопоставлял ряды между собой.
Первый вариант системы появился в 1869 году. В нем химические элементы были расположены по девятнадцати горизонтальным рядам и шести вертикальным столбцам. В 1870 году Менделеев опубликовал второй вариант системы, которая имела более привычный для нас вид: в ней вместо горизонтальных столбцов элементов появилось восемь вертикально расположенных групп, а вертикальные столбцы первого варианта превратились в периоды.
Суть открытия Менделеева заключалась в том, что с увеличением атомной массы элементов происходит периодическое изменение их свойств. После определенного количества элементов, различных по свойствам и расположенных по возрастанию атомного веса, свойства начинают повторяться.
Отличие работы Менделеева от работ его предшественников заключалось в том, что у него было две основы для классификации элементов – химическое сходство и атомная масса. Для полного соблюдения периодичности химик был вынужден исправить атомные массы некоторых элементов. Также ученый оставил в таблице пустые клетки, где, как он предполагал, должны разместиться пока еще не открытые элементы.
В 1871 году работы ученого легли в основу периодического закона, сформулированного Менделеевым. Дальнейшее развитие периодической системы связано с заполнением пустых клеток таблицы, куда помещались все новые и новые элементы. В 2010 году был завершен седьмой период периодической системы. Вот как сейчас выглядит полная таблица Менделеева.
Самыми распространенными являются три формы таблицы Менделеева: короткопериодная, длиннопериодная и сверхдлинная. В сверхдлинном варианте каждый период занимает одну строчку. Что касается длинного варианта, в нем из общей таблицы вынесены лантаноиды и актаноиды. В короткой форме четвертый и последующий периоды занимают по две строчки, а символы химических элементов, принадлежащих главным и побочным подгруппам, выравниваются относительно разных краев клеток.
Короткую форму таблицы, содержащей восемь групп элементов, официально отменили в 1989 году. Несмотря на рекомендацию пользоваться длинной формой, в большом числе российских справочников и пособий продолжает приводиться короткая форма. Правда, из современной иностранной литературы короткую форму полностью исключили, и вместо нее применяется длинная форма. Некоторые исследователи связывают данную ситуацию с тем, что короткая форма таблицы кажется более компактной.
В 1970 году Теодором Сиборгом была предложена расширенная периодическая таблица элементов. Нильс Бор занимался разработкой лестничной (пирамидальной) формы периодической системы. Существует большое количество других оригинальных, но при этом редко или вовсе не используемых способов графического отображения периодического закона. На сегодняшний день существуют сотни вариантов таблицы Менделеева, и при этом ученые предлагают все новые варианты.
Нильс Бор занимался разработкой лестничной (пирамидальной) формы периодической системы. Существует большое количество других оригинальных, но при этом редко или вовсе не используемых способов графического отображения периодического закона. На сегодняшний день существуют сотни вариантов таблицы Менделеева, и при этом ученые предлагают все новые варианты.
Периодическая система Менделеева – важнейшая веха в развитии атомно-молекулярного учения. Именно благодаря ей возникло современное понятие о химическом элементе и были уточнены представления о простых веществах и соединениях. Также периодическая таблица стала готовой систематизацией типов атомов для новых разделов физики. С помощью исследований атома методами физики удалось выяснить, что порядковый номер элемента является мерой электрического заряда ядра данного элемента, число электронных оболочек атома определяется номером горизонтального ряда в таблице, а номер вертикального ряда определяет квантовую структуру верхней оболочки.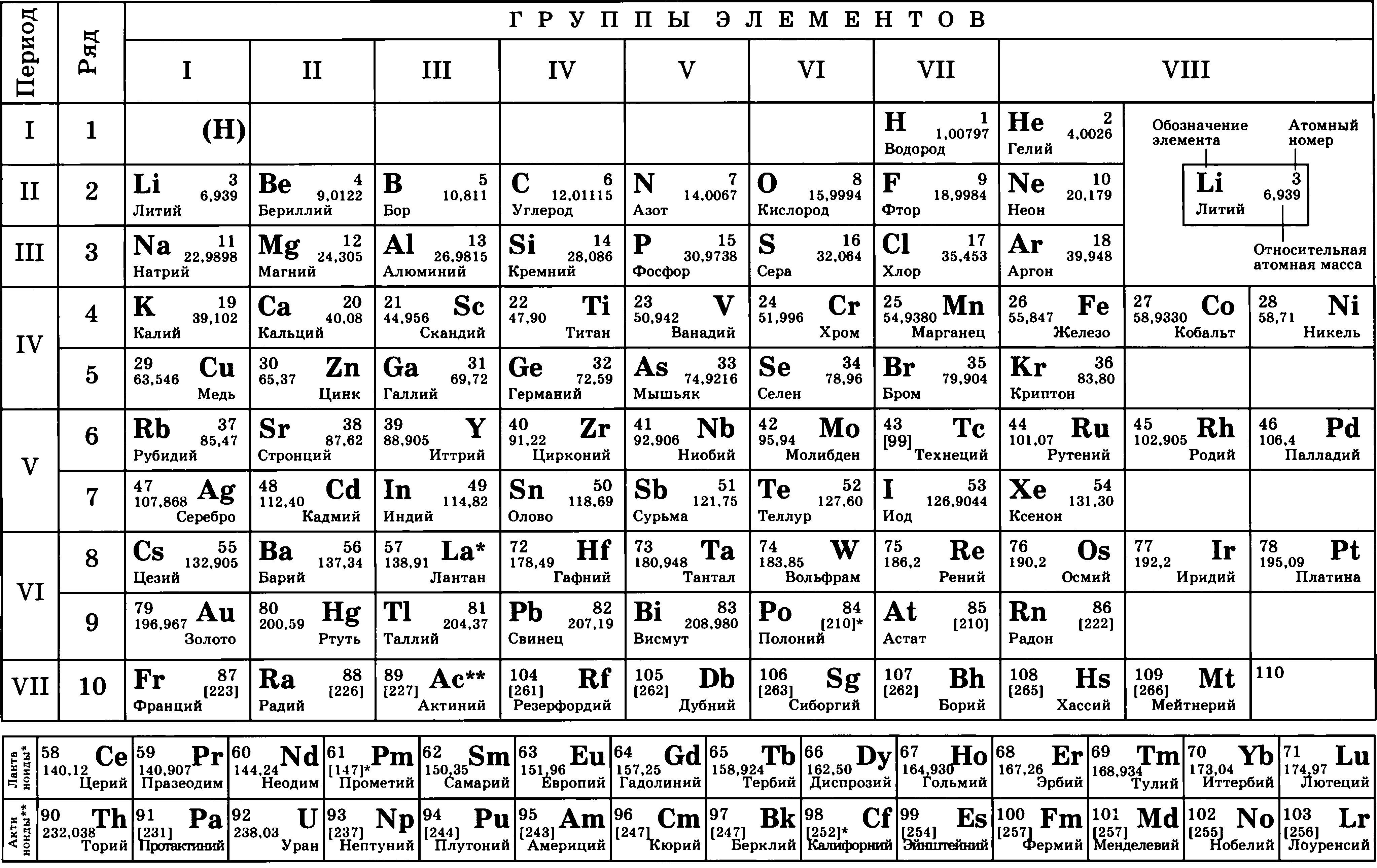
Появление полной системы Менделеева открыло новую научную эру в истории химии и других наук. Вместо разрозненных сведений о химических элементах и их соединениях возникла стройная система, благодаря которой стало возможным обобщать, предвидеть и делать выводы.
Селфи на фоне Таблицы Менделеева
«Периодическая таблица – это одно из величайших достижений в науке во все времена», — заявил президент Академии наук Франции Пьер Корволь на открытии Международного года Периодической таблицы химических элементов. В Москве и в Париже дали старт длинной череде мероприятий, смысл которых очень прост – напомнить человечеству, чем оно обязано Дмитрию Менделееву, открывшему 150 лет назад Периодический закон.
«ООН намеревается таким образом донести мысль о том, как химия способна в современном мире способствовать устойчивому развитию и выдвинуть решения для вызовов планетарного масштаба в таких разных областях, как энергия, образование, сельское хозяйство или здравоохранение», — пишет портал physicsworld. com.
com.
Любопытно, что нынешний год также провозглашен Годом Леонардо в честь 500-летия со дня смерти великого флорентийца. Если иметь в виду широту научных интересов и вклад в различные области знаний, Менделеев – это и есть русский Леонардо.
Эсперанто для ученых
«Мы, ученые, высоко ценим Периодическую таблицу, потому что она представляет собой общий язык, на котором мы все говорим», — подчеркнул Нобелевский лауреат по химии 2016 г. голландец Бен Феринга. Как известно, самого Менделеева трижды выдвигали на Нобелевскую премию, но он так и не получил ее.
Первый квартал иннограда Сколково носит имя Дмитрия Менделеева. Фото: Sk.ru
В Москве на заседании комитета по проведению Международного года Периодической таблицы химических элементов глава Российской академии наук Александр Сергеев сказал: «Мы в РАН считаем, что есть три основные цели, которые страна наша должна решить в этот год. Первое, чтобы Периодическую таблицу химических элементов все стали называть таблицей Менделеева, чтобы мы получили, наконец, Нобелевскую премию в этом году, и третье — чтобы мы выиграли олимпиаду по химии в Париже», — заявил он.
«Периодическая таблица есть попытка познать природу всех вещей», — сформулировала свое отношение к открытию Менделеева генеральный секретарь ЮНЕСКО, выступая в Париже в штаб-квартире этой организации Одри Азуле. Министр науки и высшего образования РФ Михаил Котюков там же выразил мнение, что наследие Менделеева принадлежит всему человечеству. С чем участники торжественного собрания вполне согласились.
Помимо того, что Менделеев открыл Периодический закон, выходец из Тобольской губернии, 17-й сын в семье, конструировал летательные аппараты (его называют изобретателем аэростата) и занимался кораблестроением, в том числе, принимал участие в строительстве первого в мире арктического ледокола «Ермак». К числу его изобретений относят бездымный порох и нефтепровод, а на досуге ученый занимался тем, что делал чемоданы, которые сегодня назвали бы «дизайнерскими».
«Мы, ученые, высоко ценим Периодическую таблицу, потому что она представляет собой общий язык, на котором мы все говорим»
При этом сам Дмитрий Менделеев считал своей главной заслугой не Периодический закон, а введенный в России таможенный тариф, необходимость которого он сформулировал в книге «Разумный тариф». «Какой я химик, я — политэконом; что там «Основы» [химии], вот «Толковый тариф» — это другое дело», — писал он.
«Какой я химик, я — политэконом; что там «Основы» [химии], вот «Толковый тариф» — это другое дело», — писал он.
И был великий эконом
«Если говорить о широте его научных интересов, то Менделеев по большому счету был не только великим химиком, но и выдающимся экономистом, выстраивавшим тесную связь между наукой и индустрией», — считает вице-президент Фонда «Сколков» по науке и образованию Николай Суетин. – И это один из важных уроков, которые представляет для «Сколково» наследие Менделеева.
Я бы назвал его научно-экономическим гением страны. Прежде всего, он был практикующим ученым, который не сидел в башне из слоновой кости и использовал научные достижения в реальной жизни». Да и вообще был очень «приземленным» ( в лучшем смысле этого слова) человеком.
Как раз в этом и заключается смысл деятельности «Сколково». Неслучайно, первый квартал иннограда назван именем Менделеева, а фасады его зданий стилизованы под Периодическую таблицу.
Самый известный пример – когда он буквально в течение нескольких месяцев оптимизировал технологию производства керосина в Баку. «Злые языки» говорят, что это в итоге и поссорило его с семейством Нобилей, которые активно там работали, и как следствие – закрыло ему путь к Нобелевской премии.
«Злые языки» говорят, что это в итоге и поссорило его с семейством Нобилей, которые активно там работали, и как следствие – закрыло ему путь к Нобелевской премии.
Вице-президент Фонда «Сколково» по науке и образованию Николай Суетин: «Я бы назвал Менделеева научно-экономическим гением страны». Фото: Sk.ru
Или взять введение по инициативе Менделеева таможенного тарифа. «В России все очень гордились строительством железных дорог, но при этом все железо закупали за рубежом за золото; благодаря строительству российских железных дорог в Германии металлургия получила дополнительное развитие, — напоминает вице-президент «Сколково». Благодаря введению таможенных тарифов начали развивать собственную металлургию. То же самое – с угольной промышленностью. За что ни возьмись, Менделеев всегда делал упор на связь между наукой и экономикой».
Сама история создания Периодического закона преподносит нам еще один урок, продолжает Николай Суетин: «Почему вообще появилась таблица Менделеева? В 1869 году, к тому моменту, когда Менделеев создал Периодическую таблицу, было известно только 60 элементов, причем массы ряда элементов были определены неправильно, а о существовании атома не догадывались. Не было никакой квантовой механики. Были некие вещества, которые считались фундаментальными, и из них, как полагали, состояла вся природа.
Не было никакой квантовой механики. Были некие вещества, которые считались фундаментальными, и из них, как полагали, состояла вся природа.
«Если говорить о широте его научных интересов, то Менделеев по большому счету был не только великим химиком, но и выдающимся экономистом, выстраивавшим тесную связь между наукой и индустрией»
Менделеев сформулировал свой закон, когда писал учебник «Основы химии». Он обнаружил, что если элементы выстроить по увеличению их веса, то возникает некая периодичность, которую можно представить в виде таблицы с заполненными и пустующими клетками. В ней по горизонтали выстроены элементы по возрастанию их массы, а по вертикали – с одинаковыми химическими свойствами. Были какие-то элементы, масса которых не соответствовала закономерности, в следствие чего ее впоследствии скорректировали. И были дырки, где элементов не было, но было ясно, что они должны там быть, и эти элементы потом нашли. В том числе, три – еще при жизни самого Менделеева. Т.е.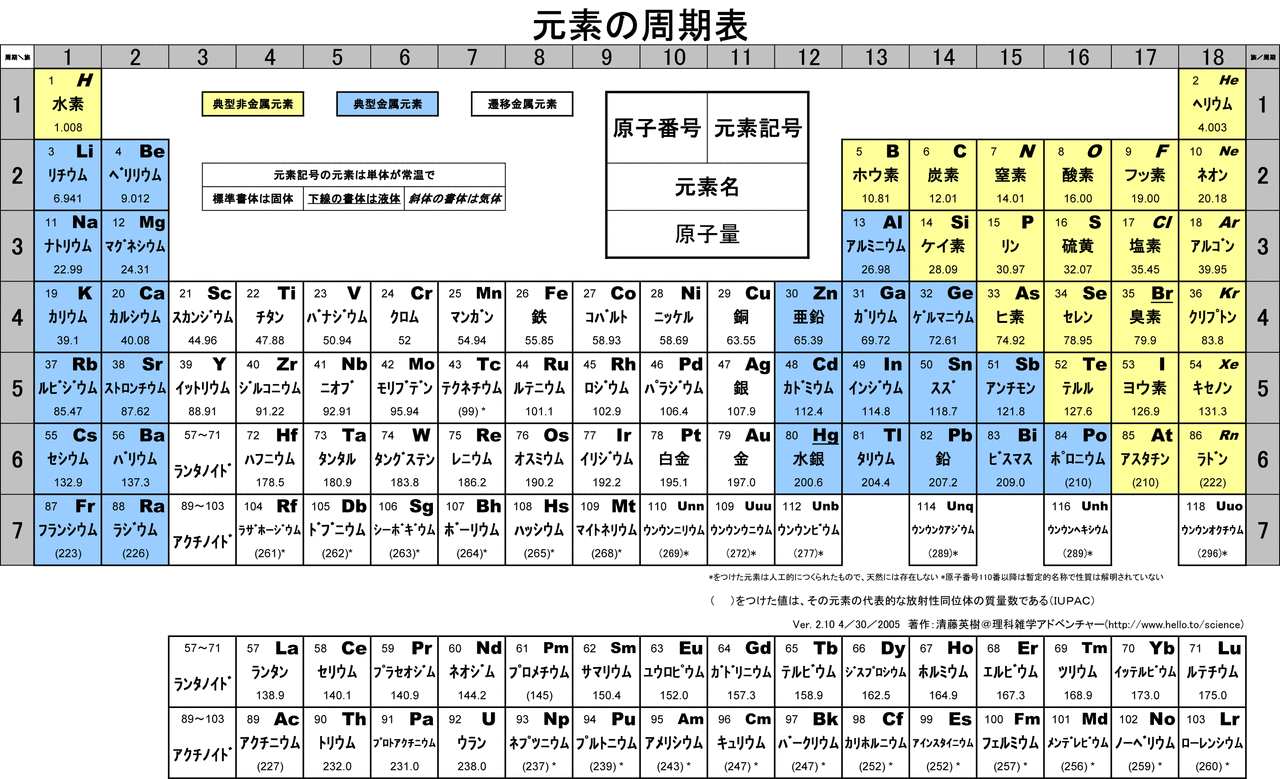 многие элементы были открыты потому, что они были предсказаны Таблицей Менделеева, и их искали целенаправленно, хотя в природе они встречаются редко.
многие элементы были открыты потому, что они были предсказаны Таблицей Менделеева, и их искали целенаправленно, хотя в природе они встречаются редко.
Вот так написание учебника, т.е. образовательная деятельность, дала выдающийся научный результат. Соединение науки и образования всегда важно, и это один из главных уроков, которые дает нам Менделеев», — считает Н.Суетин.
Сегодня в Таблице Менделеева почти в два раза больше элементов, чем 150 лет назад. Фото: Sk.ru
Судьба некоторых изобретений Менделеева тоже представляет собой определенный урок для дня сегодняшнего. Состав и метод производства бездымного пороха, разработанный Менделеевым, был запатентован не в России, а в Америке, вследствие чего Россия закупала «менделеевский порох» из-за океана. Что еще раз подчеркивает важность международной защиты, создаваемой интеллектуальной собственности.
В юбилейный год не принято вспоминать о проблемах, но Дмитрий Менделеев не был принят в Императорскую академию наук, хотя был членом множества зарубежных. Более того, когда из-за нарушения властями академических свобод ученый покинул петербургский университет, коллеги не стали его удерживать, хотя студенты и выходили на акции протеста.
Более того, когда из-за нарушения властями академических свобод ученый покинул петербургский университет, коллеги не стали его удерживать, хотя студенты и выходили на акции протеста.
«Есть такая беда: во все времена в стране было что-то неладное с признанием собственных гениев, — говорит Николай Суетин. – «Нет пророка в своем отечестве»: на Нобелевскую премию Менделеева выдвигали иностранцы, а члены Императорской академии наук при тайном голосовании неоднократно отвергали его кандидатуру. Хотя к Менделееву с очень большим уважением относились промышленники, и предприниматели, да и многие члены правительства, министры».
Тусовка длиною в год
По прошествии 150 лет Менделееву с лихвой воздают должное и на Родине, и далеко за ее пределами.
«Периодическая таблица есть попытка познать природу всех вещей»
Портал physicsworld.com в репортаже из штаб-квартиры ЮНЕСКО обращает внимание на то, что старт международного года в ЮНЕСКО был обставлен как веселая тусовка. В зале звучали музыкальные интерлюдии в исполнении знаменитой пианистки Миры Евтич. В кулуарах посетители толпились в молекулярном баре, выстраиваясь в очередь за мороженым, приготовленным с помощью жидкого азота. Можно было даже сделать селфи в интерьерах воссозданного для этой цели в Париже кабинета Менделеева.
В зале звучали музыкальные интерлюдии в исполнении знаменитой пианистки Миры Евтич. В кулуарах посетители толпились в молекулярном баре, выстраиваясь в очередь за мороженым, приготовленным с помощью жидкого азота. Можно было даже сделать селфи в интерьерах воссозданного для этой цели в Париже кабинета Менделеева.
Месседж вполне прозрачен: перефразируя Пушкина, быть можно важным в науке человеком и при этом делать селфи с Менделеевым. И, конечно, это нетривиальный способ популяризации науки.
Фото: Sk.ru.
В России наука также нуждается в творческой популяризации, и «Сколтех, как никто другой, сейчас выполняет эту роль», — считает вице-президент Фонда «Сколково» по науке и образованию. Именно здесь выпустили первый сборник комиксов, основанных на реальных научных исследованиях российских ученых. Научно-просветительский проект Сколтеха «Это точно. Чертова дюжина комиксов о науке и ученых» отмечен дипломом в специальной номинации «Прорыв года» V Всероссийской премии «За верность науке».
«Сколтех проникся идеей, что науку надо популяризировать, — утверждает Николай Суетин. — Благодаря академику Александру Кулешову профессора активно участвуют в «Сириусах», других научно-популярных мероприятиях для детей. На мой взгляд, лучший популяризатор науки в России сейчас – профессор Сколтеха Константин Северинов: никто лучше него не рассказывает о том, что такое генетика, редактирование генома».
В этом смысле стартовавший в феврале Международный год Периодической таблицы химических элементов дает хороший шанс для популяризации наследия Менделеева, о котором миллениалы знают по преимуществу то единственное, чего он никогда не делал: да, Менделеев не изобретал водку.
классных ресурсов | Единичный план периодической таблицы
Сводка
Библиотека ресурсов и мультимедийная коллекция AACT для классов средней школы содержит все необходимое для составления единичного плана для вашего класса: уроки, занятия, лабораторные работы, проекты, видео, симуляции и анимации. Используя ресурсы AACT, мы составили план занятий, который предназначен для обучения ваших учеников Периодической таблице.
Класс
Средняя школа
Цели
К концу этого раздела учащиеся должны уметь:
- Понимать, как организована периодическая таблица, и классифицировать элементы по фамилии, номеру группы и номеру периода .
- Распознать закономерность физических свойств элементов по отношению к периоду и столбцу.
- Понимать и уметь предсказывать тенденции изменения атомного радиуса, ионного радиуса и энергии ионизации.
- Определять неизвестные элементы на основе их свойств атомного радиуса, пластичности, проводимости и энергии ионизации.
- Классифицирует элемент как металл, неметалл или металлоид на основе его физических и химических свойств.
- Признать вклад важных ученых в систематизацию таблицы Менделеева с течением времени.
- Поймите, что текущая таблица Менделеева была разработана с течением времени на основе многих открытий, моделей и исправлений.
Темы химии
Этот урок помогает учащимся понять
- Периодическая таблица
- Физические свойства
- Периодические тенденции
- Атомный радиус
- Ионный радиус
- Энергия ионизации
- Металлические свойства
Время
Подготовка учителя: См. Отдельные ресурсы
Урок: 7–10 учебных часов, в зависимости от уровня класса
Материалы
- См. Список материалов, предоставляемый для каждого отдельного занятия.
Безопасность
- См. Инструкции по технике безопасности для каждого отдельного вида деятельности.
Заметки для учителя
- Указанные ниже задания перечислены в том порядке, в котором они должны быть выполнены.
- Заметки учителя, раздаточные материалы для учащихся и дополнительные материалы доступны на странице для каждого отдельного занятия.
- Обратите внимание, что большинство этих ресурсов являются преимуществами для участников AACT.
Периодическая таблица | Глава 4: Периодическая таблица и связь
Познакомить студентов с периодической таблицей.
Спроецировать изображение Периодической таблицы.
Скажите студентам, что это периодическая таблица Менделеева. Объясните, что в каждом поле содержится информация об отдельном атоме. В периодической таблице показаны все атомы, из которых состоит все в известной вселенной. Это что-то вроде алфавита, в котором всего 26 букв в разных комбинациях составляют многие тысячи слов. Около 100 атомов периодической таблицы в различных комбинациях составляют миллионы различных веществ.
Примечание: учащихся часто сбивает с толку, когда термины «атом» и «элемент» используются как взаимозаменяемые, как если бы они были одним и тем же. Объясните учащимся, что атом — это мельчайшая частица или «строительный блок» вещества. Элемент — это вещество, состоящее из атомов одного и того же типа. Например, кусок чистого углерода состоит только из атомов углерода. Этот кусок чистого углерода является образцом элементарного углерода. Люди, которые разработали периодическую таблицу, могли бы назвать ее Периодической таблицей атомов, но в то время у них не было твердого понимания атомов.Поскольку они работали с реальными образцами таких элементов, как медь, ртуть, сера и т. Д., Они назвали ее периодической таблицей элементов.
Дополнительно
Воспроизведите одну или обе следующие песни.
- Элементы Тома Лерера с анимацией Майка Стэнфилла
- www.privatehand.com/flash/elements.html
- Знакомство со стихиями, возможно, гигантами
- www.youtube.com/watch?v=d0zION8xjbM
Объясните значение цифр и букв в прямоугольниках периодической таблицы.
Сообщите учащимся, что в течение 2 дней класс сосредоточится на первых 20 элементах. В первый день они будут смотреть на количество протонов, электронов и нейтронов в атомах каждого элемента. На второй день они будут смотреть на расположение электронов в атомах.
- Раздайте каждому студенту экземпляр периодической таблицы элементов, периодической таблицы элементов 1–20 и листа с заданиями.
- Учащиеся будут использовать периодическую таблицу элементов 1–20 вместе с листом заданий на уроке, который они проведут сегодня.
Спроецируйте изображение Периодической таблицы первых 20 элементов.
Проецировать изображение Объяснение элемента.
Объясните, что обозначают цифры и буквы в каждой рамке периодической таблицы.
Объясните атомную массу.
Атомная масса элемента основана на массе протонов, нейтронов и электронов атомов этого элемента.Масса протона и нейтрона примерно одинакова, но масса электрона намного меньше (примерно 1/2000 массы протона или нейтрона). Большую часть атомной массы составляют протоны и нейтроны.
Для любого элемента периодической таблицы количество электронов в атоме этого элемента всегда равно количеству протонов в ядре. Но это не так для нейтронов. Атомы одного и того же элемента могут иметь разное количество нейтронов, чем протонов.Атомы одного и того же элемента с разным числом нейтронов называются изотопами этого элемента. Атомная масса в периодической таблице — это среднее значение атомной массы изотопов элемента. Для атомов первых 20 элементов количество нейтронов либо равно количеству протонов, либо немного превышает его.
Например, подавляющее большинство атомов углерода имеют 6 протонов и 6 нейтронов, но небольшой процент состоит из 6 протонов и 7 нейтронов, а еще меньший процент состоит из 6 протонов и 8 нейтронов.Поскольку большинство атомов углерода имеют массу, очень близкую к 12, и только небольшой процент больше 12, средняя атомная масса немного больше 12.
Опишите деятельность, которую студенты будут выполнять, чтобы узнать о первых 20 элементах таблицы Менделеева.
Покажите учащимся, что у вас есть 100 карточек (по 5 на каждый из первых 20 элементов). Объясните, что каждая карточка содержит информацию об одном из первых 20 атомов таблицы Менделеева.Задача учеников — внимательно прочитать карточку, выяснить, какой атом она описывает, и положить карточку в то место в комнате, где находится этот атом.
Просмотрите информацию о протонах, электронах и нейтронах, которые необходимо знать учащимся, чтобы сопоставить карточки с правильным элементом:
Протон
- Положительно заряженная частица в ядре атома.
- Число протонов в ядре атома — это атомный номер.
Электрон
- Отрицательно заряженная частица, окружающая ядро атома.
- Число электронов, окружающих ядро атома, равно числу протонов в ядре атома.
Нейтрон
- Частица в ядре, которая имеет почти такую же массу, как протон, но не имеет заряда.
- Для атомов первых 20 элементов количество нейтронов либо равно количеству протонов, либо немного превышает его.
Чтобы сопоставить количество нейтронов, перечисленных на вашей карте, с правильным элементом, найдите элемент в периодической таблице, чтобы, если вы добавите количество нейтронов на вашей карте к протонам элемента, вы приблизитесь к атомная масса этого элемента. Например, у вас может быть карточка, на которой написано, что у искомого атома 5 нейтронов. Вы бы посмотрели на периодическую таблицу, чтобы найти атом, который вы могли бы добавить 5 к его количеству протонов, что дало бы вам сумму, близкую к атомной массе, данной для этого элемента.Ответ — бериллий (Be), который имеет 4 протона и атомную массу 9,01.
Примечание: есть несколько нейтронных карт, которые содержат два возможных правильных элемента вместо одного:
- 6 нейтронов — бор или углерод
- 10 нейтронов — фтор или неон
- 12 нейтронов — натрия или магния
- 16 Нейтронов — фосфор или сера
- 20 нейтронов — калий или кальций
Попросите группы работать вместе, чтобы разместить каждую карту с ее правильным атомом.
Раздайте карточки по группам. Если у вас 10 групп, каждая группа получит по 10 карточек. Будьте готовы помочь студентам, у которых проблемы с нейтронами и атомной массой.
Обсудите размещение карт для двух или трех атомов.
Выберите два или три атома и проверьте, правильно ли были размещены карты. Этот обзор поможет укрепить представления о структуре атомов и поможет студентам определить количество протонов, электронов и нейтронов в каждом типе атома.
Попросите учащихся начать заполнение листа деятельности со следующей информацией:
- Число протонов
- Количество электронов
- Количество нейтронов (обычно)
Познакомьте учащихся с их проектом по элементу и онлайн-ресурсом, который они могут использовать.
Назначьте каждому учащемуся элемент. Включите первые 20 элементов и любые другие элементы, которые вам интересны, чтобы каждый учащийся мог исследовать и представить свои собственные.
Каждый ученик должен найти и представить классу некоторую основную информацию о своем элементе. Презентация может быть в виде плаката, брошюры, презентации PowerPoint или другой формы. Презентации должны быть краткими и могут включать: имя атома, атомный номер, происхождение имени, время и место обнаружения, естественные источники элемента, основные применения и любую другую информацию, которую вы сочтете важной.
Некоторые онлайн-таблицы Менделеева могут быть ошеломляющими для учеников средней школы.Эта красочная интерактивная периодическая таблица элементов содержит достаточно информации и ресурсов, чтобы быть полезной для учащихся, но не пугающей из-за перегрузки технической информации.
https://elements.wlonk.com/ElementsTable.htm
Если есть время, попросите учащихся поработать над этим проектом Atom в течение недели.
| Периодическая таблица Класс: 6 — 12 Периодическая таблица для детей — Урок знакомит с периодической таблицей и ее историей.Урок охватывает — Дмитрий Менделеев, организация Менделеева периодической таблицы, отношения в периодической таблице и многое другое. 11:20 |
| Детский химик: Периодическая таблица, часть 1 Класс: 6 — 12 Урок дает обзор периодической таблицы элементов. 8:20 |
| Junior Chemistry: Periodic Table, part 2 Grade: 6 — 12 Видео предоставляет обзор субатомных частиц и изотопов. 4:35 |
| Группы Периодической таблицы Класс: 6-12 Урок по таблице Менделеева — узнайте о свойствах щелочных, щелочноземельных и переходных металлов, галогенов и благородные газы. 11:50 |
| Атомы и Периодическая таблица элементов Класс: 6 — 12 Отправьтесь в путешествие по истории физики элементарных частиц.Узнайте, что греки знали об атомах и что периодическая таблица Менделеева была одним из первых указаний на то, что атом имеет более глубокую структуру. 2:05 |
| Введение в Периодическую таблицу Класс: 6 — 12 В презентации обсуждается периодическая таблица элементов. 2:45 |
| Как элементы получили свои имена? Класс: 6 — 12 Помните периодическую таблицу элементов? В каждой коробке есть история. 3:55 |
| 118 элементов — Периодическая таблица Класс: 6 — 12 Обзор периодической таблицы, охватывающей каждый из 118 элементов. 10:10 |
| Водород Класс: 6 — 12 Урок «Водород и его свойства». Посмотрите, как взрывается воздушный шар, но что создает огненный шар? 7:15 |
| Литий Класс: 6 — 12 Урок по Литию — щелочному металлу и третьему элементу в периодической таблице. 2:40 |
| Натрий Класс: 6 — 12 Узнайте о свойствах натрия — знаменитого реактивного элемента. 4:40 |
| Калий Класс: 6 — 12 Урок калия — «жестокого» элемента, но жизненно важного. В этом уроке вы увидите несколько сильных взрывов и мягкое создание калиевого зеркала. 4:35 |
| Сера Класс: 6 — 12 Узнайте о свойствах серы. 6:30 |
| Oxygen Классы: 6 — 12 Урок по Oxygen. На уроке представлены кадры, демонстрирующие парамагнетизм жидкого кислорода. 6:15 |
| Азот Класс: 6 — 12 Узнайте об азоте — 7-м элементе периодической таблицы и самом распространенном элементе в атмосфере Земли. 4:05 |
| Гелий Класс: 6 — 12 Урок гелия — 2-го элемента периодической таблицы, обычно используемого в плавающих воздушных шарах. 4:45 |
| Неон Класс: 6 — 12 Узнайте о неоне — инертном газе, 10-м элементе периодической таблицы, обычно используемом в ярких неоновых рекламных вывесках. 1:55 |
| Аргон Класс: 6 — 12 Урок об аргоне — инертном благородном газе, элементе номер 18 и третьем по распространенности газе в атмосфере Земли. 1:25 |
| Фосфор Класс: 6 — 12 Узнайте о свойствах фосфора — очень реактивного элемента, который играет жизненно важную роль в организме человека. 3:35 |
| Магний Класс: 6 — 12 Узнайте о магнии — металле и 12 элементе в периодической таблице, который, как известно, очень ярко горит при воздействии огня . 1:35 |
| Железо Класс: 6 — 12 Урок железа — самого распространенного элемента, образующего планету Земля. 5:55 |
| Бор Класс: 6 — 12 Узнайте о свойствах бора — 5-го элемента в периодической таблице. 4:00 |
| Алюминий Класс: 6-12 Урок алюминия — серебристо-белый, мягкий, пластичный металл с широким использованием — от фольги, которая обертывает наш обед, до самолета тела. 1:25 |
| Золото, серебро и бронза Класс: 6–12 Узнайте о трех элементах, связанных с Олимпийскими играми — золоте, серебре и бронзе. 9:45 |
| Медаль из 13 металлов Класс: 6 — 12 В презентации рассматриваются 13 элементов и их свойства. 9:40 |
Периодическая таблица виртуального класса | Абилин, Техас
Добро пожаловать в виртуальный класс публичной библиотеки Абилина.Это пространство станет новым местом для молодежи, подростков и взрослых, где они смогут больше узнать о самых разных темах, с регулярным добавлением нового контента.
Для каждого класса мы поделимся справочной информацией, образовательными видео, планами уроков, ресурсами, доступными для продолжения обучения, и многим другим. Кроме того, мы предложим ссылку на тест, который мы будем признательны, если вы его пройдете, чтобы показать, что вы узнали!
| Периодическая таблица элементов |
|---|
| Как элементы получили свои имена 3 9023 | 9006435 |
|
|---|
| Периодическая таблица — ускоренный курс по химии | |
|---|---|
| Королевское химическое общество — история периодической таблицы | |
|---|---|
Королевское химическое общество 9002 Периодическая таблица4Королевского химического общества Интерактивная таблица Менделеева содержит историю, алхимию, подкасты, видео и тенденции данных по периодической таблице.Скопируйте и вставьте следующий URL-адрес в свой браузер, https://www.rsc.org/periodic-table/history, затем щелкните вкладки вверху и изучите каждый раздел. Используйте кнопки, чтобы изменить свой взгляд на таблицу Менделеева. Мюррей Робертсон отвечает за оформление визуальных элементов. Щелкните каждый элемент, чтобы прочитать подробную информацию об истории элемента, включая ученых, которые открыли элемент и когда. |
| Карьера в химии | |
|---|---|
| Посмотрите это видео и откройте для себя различные вакансии в области химии. .Ведущий рассказывает о том, что вам нужно делать в колледже, чтобы приобрести навыки, необходимые в этой области. Он описывает необходимые навыки, работу и карьеру, начальную работу в качестве лаборанта, химика начального уровня, стажировки и аспирантуру. Он также исследует карьеру в химии, которую можно сделать после того, как студент получит степень магистра, различные отрасли, в которых работают химики, построение здорового резюме и создание социальной сети. Докладчик дает советы по поиску работы, исследованиям в бакалавриате и развитию навыков межличностного общения. |
План урока по периодической таблице и трансурановым элементам
Классы: 9-12
Предметные области: Химия и история
Главный автор: Сьюзан Купер
Следующие задания для учащихся на основе запросов предназначены для использования при планировании уроков химии в средней школе, но они применимы ко всем естественным предметам. Некоторые учителя средних школ также могут найти план урока полезным. План урока поможет студентам узнать о людях и открытиях, которые привели к созданию современной таблицы Менделеева.Заключительное задание включает письмо, поскольку студентов просят обобщить то, что они узнали о периодической таблице.
Содержание разработано как готовый урок, легко реализуемый учителем или его / ее заместителем в дополнение к учебной единице. Студенты будут практиковать навыки критического чтения и письма, поскольку они разовьют более глубокое понимание развития периодической таблицы.
Загрузите полный план урока (PDF).
- Руководство для учителя: Включает раздаточный материал, задания для учащихся и руководство по ответам
- Раздаточный материал: «Периодическая таблица и трансурановые элементы»
- Занятия для учащихся: Включите шесть занятий, описанных ниже.
Активность студентов:
Хотя эти мероприятия тематически связаны, каждое из них разработано как отдельное дополнение к раздаточному материалу. Учителя могут выбирать занятия в зависимости от учебных потребностей и времени.
- Руководство для предвидения и чтения «Периодической таблицы и трансурановых элементов» Учащиеся сталкиваются со своими идеями о развитии периодической таблицы. (5 минут вступления, 15-20 минут чтения)
- Упражнение по истории: хронология событий Учащиеся хронологически упорядочивают события по чтению.(10-15 мин.)
- Графический органайзер: Вклад химиков в сегодняшнюю версию таблицы Менделеева. Учащиеся описывают вклад, сделанный различными химиками, а также значение каждого вклада. (5–10 мин.)
- Графический органайзер и вопросы: открытие элементов Учащиеся систематизируют выбранные элементы в виде таблицы и отвечают на вопросы о проблемах, которые необходимо было преодолеть при обнаружении трансурановых элементов.(10–15 мин.)
- Письменное упражнение: значение Периодической таблицы и трансурановых элементов Учащиеся обобщают развитие периодической таблицы Менделеева и ее важность для химиков. (15–20 мин.)
- Дополнительные видеообращения Прочитав раздаточный материал, студенты смотрят видеоролик ACS Reactions, связанный с периодической таблицей, и делятся своими знаниями с классом. (15–30 мин., В зависимости от выбора учителя)
It’s Elemental — Периодическая таблица элементов
Периодическая таблица элементов
| Перечислено по химическому названию | Перечислены по атомному номеру | Перечислено химическим символом | Водород1H Гелий2Не Литий3Li Бериллий4Be Бор5B Углерод6C Азот7N Кислород8O Фтор9F Neon10Ne Натрий11Na Магний12Mg Алюминий13Al Кремний14Si Фосфор15P Сера16S Хлор17Cl Аргон18Ar Калий19K Кальций20Ca Скандий21Sc Титан22Ti Ванадий23V Хром24Cr Марганец25Mn Утюг26Fe Cobalt27Co Никель28Ni Медь29Cu Цинк30Zn Галлий 31Ga Германий32Ge Мышьяк33As Селен34Se Бром35Br Криптон36Kr Рубидий37Rb Стронций38Sr Иттрий39Y Цирконий40Zr Ниобий41Nb Молибден42Mo Технеций43Tc Рутений44Ru Родий45Rh Палладий46Pd Серебро47Ag Кадмий 48Cd Индий49In Олово50Сн Сурьма51Sb Теллур52Te Йод53I Ксенон54Xe Цезий55Cs Барий56Ba Лантан57La Церий58Ce Празеодим59Pr Неодим60Nd Прометий 61Pm Самарий62см Европий63Eu Гадолиний64Gd Тербий65Tb Диспрозий66Dy Гольмий67Ho Эрбий68Er Тулий69Tm Иттербий70Yb Лютеций71Lu Гафний72Hf Тантал73Ta Вольфрам74Вт Рений75Re Осмий76Os Иридий77Ir Платина78Pt Золото79Au Меркурий80Hg Таллий 81Tl Свинец82Pb Висмут83Bi Полоний84Po Астатин85Ат Радон86Rn Франций87Fr Радий88Ra Актиний89Ac Торий90Th Протактиний 91 Па Уран92U Нептуний93Np Плутоний 94Pu Америций95Am Кюрий96см Беркелиум97Bk Калифорний98Cf Эйнштейний99Es Фермий100Fm Менделевий101Md Нобелий 102 Нет Лоуренсий103Lr Резерфордий104Rf Дубний105Дб Сиборгий106Sg Бориум107Bh Калий108Hs Мейтнерий 109Mt Дармштадтиум110Ds Рентгений111Rg Copernicium112Cn Нихоний113Nh Флеровий114Fl Московий115Mc Ливерморий116Lv Теннессин117Ц Оганессон118ОгСкачать версию Периодической таблицы элементов для печати в формате PDF:
— Цвет: базовый / расширенный
— Черно-белое: базовый / расширенный
Доступны следующие онлайн-игры, основанные на Периодической таблице элементов:
— Флэш-карты элементов
— Элемент Палач
— Соответствие элементов
— Элементная математика
— Элементные кроссворды
— Концентрация элемента
— Элемент балансировки
— Битва слов элементов
Доступны следующие бумажные задания:
— Элемент BINGO
— Поиск слова элемента
В дополнение к информации, содержащейся в Периодической таблице элементов, следующие статьи могут быть полезны, если вы пишете отчет об элементе или создаете модель атома:
— Как рассчитать количество протонов, нейтронов и электронов в атоме элемента
— Как сделать модель атома
— Как нарисовать атом (видео)
— Как читать электронную схему конфигурации
— Список тех, кто обнаружил каждый элемент
Информация на этом сайте собрана из ряда источников.
Цитирование и ссылки
По вопросам об этой странице обращайтесь к Стиву Ганьону.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА И ПЛАН УРОКА ПО РЕАКТИВНОСТИ — ПОЛНЫЙ УРОК НАУКИ С ИСПОЛЬЗОВАНИЕМ МЕТОДА 5E ИНСТРУКЦИИ
В конце этой периодической таблицы и плана урока по реактивности учащиеся смогут определить, что валентные электроны определяют химические свойства атома, включая реактивность и химические свойства. интерпретировать расположение периодической таблицы, чтобы объяснить, как свойства используются для классификации элементов (включая группы и периоды).Каждый урок разработан с использованием метода обучения 5E для обеспечения максимального понимания учащимися.
Следующий пост проведет вас через каждый из шагов и действий из периодической таблицы и плана урока реактивности.
В начале урока класс проведет Think-Pair-Share, чтобы обсудить цель.
Преподаватель поможет развеять неправильные представления о таблице Менделеева и реакционной способности. Некоторые серьезные заблуждения связаны с тем, что студенты не понимают, что все вещи состоят из комбинаций этих элементов, и студенты не понимают, что валентные электроны — это то, что определяет реактивность элементов.
Расчетное время занятия для помолвки: 20-30 минут
РАЗВЕДКА
Эта лаборатория станции, ориентированная на студентов, создана для того, чтобы студенты могли начать изучать периодическую таблицу и реактивность. Четыре из станций считаются входными станциями, где студенты изучают новую информацию о периодической таблице и реактивности, а четыре из станций являются выходными станциями, где студенты будут демонстрировать свое мастерство входных станций.Каждая из станций отличается, чтобы бросить вызов студентам, использующим разный стиль обучения. Вы можете узнать больше о том, как я организовал лаборатории станции здесь.
УЗНАТЬ!
Студенты будут работать в парах, чтобы лучше понять, как расположены элементы в периодической таблице. У учащихся будут карточки, которые они разложат, чтобы лучше понять, что значит быть в группе или периоде. Студенты интерпретируют эту идею как способ показать реактивность и то, как элементы обладают одинаковыми свойствами.Студенты, наконец, возьмут эту информацию и применит ее к реальной таблице Менделеева.
ПОСМОТРИТЕ!
На этой станции студенты будут смотреть семиминутный видеоролик, объясняющий устройство таблицы Менделеева. Затем учащиеся ответят на вопросы, связанные с видео, и запишут свои ответы на листах лабораторных станций. Например: Что означает атомный номер в периодической таблице? Какая часть атома позволяет одному атому реагировать с другим? Что верно для элементов, находящихся в одном столбце (группе / семействе)?
ИССЛЕДУЙТЕ ЭТО!
Исследовательская станция позволит студентам проводить исследования по построению и организации периодической таблицы.Студенты узнают о периодах, группах и фактах об элементах. Затем студентам будет предложено ответить на несколько вопросов, основанных на проведенном ими исследовании.
ПРОЧИТАЙТЕ!
Эта станция предоставит студентам одну страницу для чтения о таблице Менделеева. В ходе чтения студенты узнают, как устроена таблица Менделеева. Студенты будут знать, как называются вертикальные столбцы, а также горизонтальные строки. Учащиеся ответят на 4 дополнительных вопроса, чтобы продемонстрировать понимание предмета при чтении.
ОЦЕНИТЬ!
Станция для оценки — это место, куда студенты отправляются, чтобы доказать свое мастерство в концепциях, которые они изучили в лаборатории. Вопросы составлены в стандартизированном формате с несколькими вариантами ответов. Некоторые вопросы включают: Что не верно в отношении всех этих элементов? Какой элемент имеет 2 валентных электрона и находится в периоде 4? Какие два элемента обладают схожими свойствами? Какой элемент самый реактивный?
НАПИШИТЕ!
Студенты, которые могут ответить на открытые вопросы о лаборатории, действительно понимают изучаемые концепции.На этой станции студенты будут отвечать на три карточки с заданиями: Объяснить, что такое валентный электрон. Чем периоды и группы отличаются друг от друга? Как определить, имеют ли элементы одинаковые химические свойства?
ИЛЛЮСТРИРУЙТЕ ЭТО!
Вашим ученикам-наставникам понравится эта станция. Учащиеся раскрашивают разделы таблицы Менделеева. Студенты будут раскрашивать определенные периоды и группы, чтобы показать, что они понимают, как устроена таблица Менделеева. Студенты также пометят определенные группы, периоды и места, где можно найти элементы с одинаковым количеством валентных электронов.
ОРГАНИЗУЙТЕ ЭТО!
Станция «организовать it» позволяет вашим ученикам размещать карточки под другими карточками с названиями двух определенных элементов. Эти карты будут описывать информацию, относящуюся к элементам, которые можно интерпретировать по их расположению в периодической таблице.
Расчетное время занятий для исследования: 1-2 часа занятий по 45 минут
ПОЯСНЕНИЕ
Действия по объяснению станут намного более интересными для класса, когда они завершат лабораторию на исследовательской станции.Во время объяснения учитель проясняет любые неправильные представления о периодической таблице и реактивности с помощью интерактивной PowerPoint, якорных диаграмм и интерактивных заданий с записной книжкой. Таблица Менделеева и план урока реактивности включает PowerPoint с упражнениями, разбросанными повсюду, чтобы учащиеся были вовлечены. Учащиеся также будут взаимодействовать со своими журналами, используя шаблоны INB для периодической таблицы и реактивности. Каждое занятие INB призвано помочь студентам разделить информацию на части для лучшего понимания концепции.Периодическая таблица и шаблоны INB реактивности позволяют студентам сосредоточить свои заметки на изучении разницы между группами и периодами, а также на заметках о периодической таблице и реактивности. Расчетное время занятий для исследования: 2-3 часа, 45 минут занятий
РАЗРАБОТКА
Раздел, посвященный описанию метода обучения 5E, предназначен для того, чтобы дать учащимся возможность выбрать способ подтверждения владения концепцией. Когда ученикам предоставляется выбор, их «участие» намного больше, чем когда учитель говорит им о проекте, который им предстоит создать.Проект разработки позволит студентам создать презентацию, чтобы рассказать о периодической таблице и реактивности. Расчетное время занятий на проработку: 2–3 урока по 45 минут (также можно использовать в качестве домашнего проекта)
ОЦЕНКА
Последняя часть модели 5E — оценка понимания учащимися. В каждый урок 5E входит домашнее задание, оценка и модифицированная оценка. Исследования показали, что домашнее задание должно быть значимым и применимым к реальной деятельности, чтобы быть эффективным.Когда это возможно, мне нравится давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Расчетное время занятий на проработку: 1, 45 минут урока
СКАЧАТЬ ПОЛНЫЙ УРОК СЕЙЧАС
Полную версию урока можно загрузить в моем магазине TpT. Сэкономьте кучу времени и возьмите его сейчас.





 Доберейнера в создание современной периодической таблицы химических элементов;
Доберейнера в создание современной периодической таблицы химических элементов;