Блог команды creativo.one
Доступ
к PREMIUM-контенту
88 видеоуроков только для PREMIUM-пользователей. Коллекция пополняется несколько раз в месяц!
Обратная связь
от PRO
При добавлении работы на портал вы сможете получить обратную связь от нашего эксперта — Елены Минаковой.
Доступ к закрытым
трансляциям
Для участников PREMIUM регулярно проводятся закрытые трансляции с профессионалами. Остальным они доступны только за деньги.
Отсутствие
рекламы
PREMIUM-пользователи не видят рекламных объявлений и баннеров.
Приоритетная
проверка работ
Все работы, которые вы добавляете в портфолио, рассматриваются в приоритетном порядке.
Статистика
переходов в соцсети
Вы будете видеть, сколько человек перешли по ссылкам соцсетей из вашего профиля.
Возможность
скачивать видеоуроки
Вы сможете скачивать видеоуроки без ограничений.
PREMIUM-статус
на аватаре
На вашей аватарке будет отображаться значок, обозначающий Premium-статус.
Короткая именная
ссылка на профиль
Получите именную ссылку на профиль вида https://creativo.one/sasha
Возможность отложенной
публикации постов
Вы сами решаете, в какое время пост появится в ленте.
Светлая / темная
тема сайта
Меняйте тему оформления сайта под свое настроение.
Расширенные возможности опросов
Возможность устраивать голосование с прогрессивным рейтингом. Возможность создавать викторины (скоро).
PHOTOSHOP-МАСТЕР.RU — «С чего началось мое знакомство с миром Фотошопа? С сайта photoshop-master.
 ru!»
ru!»Сегодня мой отзыв будет о моем любимом сайте Photoshop-master. ru
Знакомство мое с этим сайтом произошло еще в 2011 году. Тогда я впервые заинтересовалась Фотошопом, и мне необходимо было учиться и развиваться в этом направлении.
Сам сайт очень удобен в плане навигации, на сайте множество уроков по тематикам, таким как:
- работа с фото
- работа с текстом
- рисование
- графика для сайта
- анимация и прочие
на сайте много уроков
Также куча дополнительных материалов для фотошопа, которые вы можете скачать абсолютно бесплатно:
- кисти
- градиенты
- шрифты
- рамки
- фоны
- и многое другое, необходимое для работы в фотошопе
Началось мое шествие к вершинам (коих я считаю, что еще далеко не достигла) владения Фотошопом с выполнения уроков. Поначалу все было сложно. Куча инструментов, фильтров, слоев, которые нужно освоить хотя бы в минимуме, да что там освоить, знать бы, где это все расположено, в какой вкладке искать.
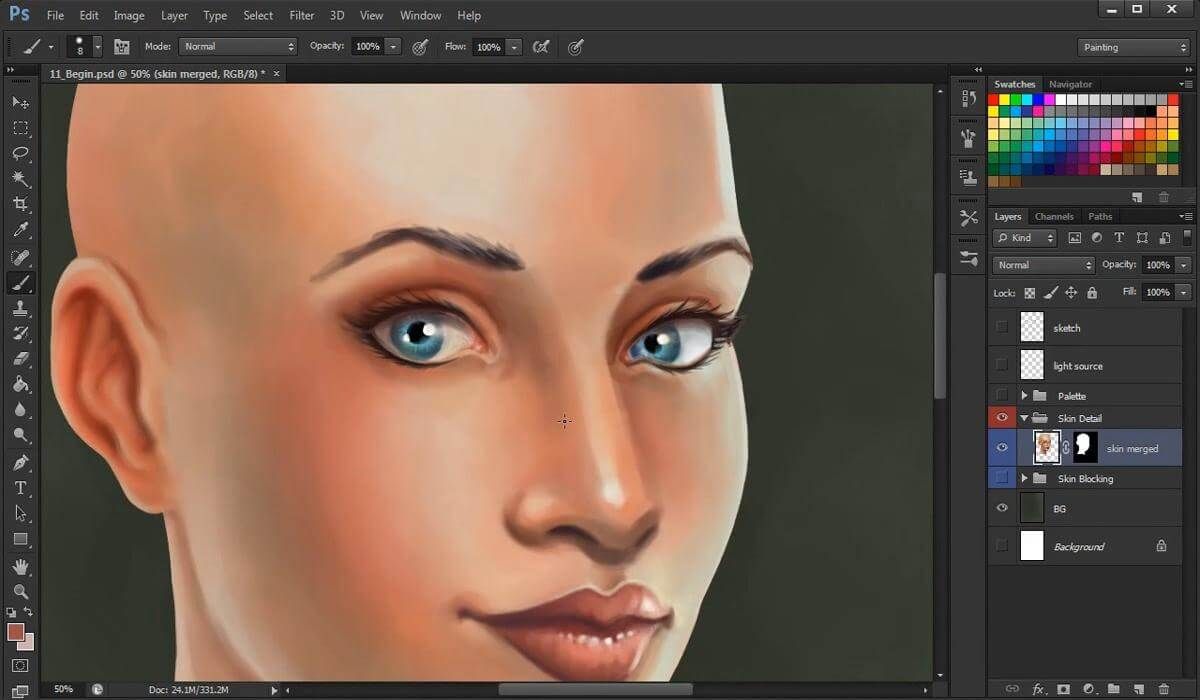
Одна из моих работ по уроку, не самая первая, но любимая)))
На сайте существует рейтинг участников, который складывается из таких параметров, как участие в конкурсах (их проводится не мало, призы денежные, я даже пару раз участвовала, но мест не занимала), выполнение уроков, участие в жизни форума и т.д.
рейтинг участников
У меня рейтинг не очень высокий, даже в первые 300 участников не вхожу, но работаю над этим. Было дело, забросила я заниматься, с головой ушла в основную работу, не до того было, но сейчас понимаю, что для меня это какая-то отдушина, можно воплотить все свои замыслы, фантазии, да все, что угодно. Фотошоп может очень и очень многое!
Ну вернемся к сайту.
Здесь имеется также форум, где можно выставить свои работы, обсудить уроки, конкурсы и работы других участников, а также поиграть в игры.
на форуме можно выставить свои работы и поиграть в игры
Все мои фотографии, выложенные на айреке, сделаны с помощью Фотошопа. Но главной моей мечтой было и остается рисование, пока что за неимением графического планшета (хотелось бы хороший, а не простой, но он стоит денежек) я оставила это занятие в сторону. Была попытка поучаствовать в конкурсе, рисовала мышкой, поэтому никаких мест работа не заняла(((
работа на конкурс
Еще одна из моих работ, то ли по уроку, то ли нет, честно, не помню, тоже где-то в начале пути сделана.
Приятно, что сайт развивается, появляется много новых уроков, новых материалов, на сайте можно встретить много отзывчивых людей, получить полезную информацию и помощь. Думаю, для многих он будет хорошей отправной точкой в покорении Фотошопа, как и для меня.
Я рекомендую сайт Photoshop-master. ru всем, кто хочет научиться пользоваться Фотошопом!
Всем пока, спасибо что зашли!
«Adobe Photoshop. Продвинутый уровень». Занятие 1.1
Конспект к первому занятию курса «Adobe Photoshop. Продвинутый уровень» в его гибридной версии, стартовавшей в 2019 году. Курс состоит из 5 видоезанятий и 5 онлайн занятий. Конспекты сделаны только для видеозанятий, поскольку на онлайн занятиях идет разбор пройденной темы и домашних заданий. Здесь можно посмотреть полное описание и программу курса.Перед записью на любой курс по Adobe Photoshop очень рекомендую прйти тест на знание программы. Как показывает опыт, самостоятельная оценка собственных знаний не всегда адекватно отражает их действительный уровень.
Дополнительные материалы — материалы, рекомендованные к изучению в процессе прохождения курса.
Для самостоятельного изучения — материалы, рассчитанные на самостоятельное освоение не только в процессе, но и по окончании курса.
Для стандартизации внешнего вида, обеспечения стабильности и удобства доступа, данные материалы представлены в виде документов Evernote с упрощенным форматированием. Чтобы перейти к оригиналу статьи, кликните по адресу сайта непосредственно под ее названием.
Для лучшей связи конспекта и занятия в соответствующих местах помещены миниатюры разбираемых в этот момент изображений.
Задачи на занятие
1. Понять что такое мастер-кривая и когда ее можно применять
2. Освоить поканальную работу с кривыми и научиться избавляться от негативных последствий такой работы
3. Познакомиться с поканальным устройством изображения
4. Освоить технику смешивания каналов
Дополнительные материалы:
Андрей Журавлев «Кошачьи истории или правила работы с кривой»
Андрей Журавлев. «Практикум работы с кривой или о чем умолчал Маргулис»
Для самостоятельного изучения:
Liveclasses. Adobe Photoshop: новая коррекция монохромных изображений
Liveclasses. Основы теории цвета. Модели RGB, CMY, HSB
Основы теории цвета. Модели RGB, CMY, HSB
Liveclasses. Photoshop Curves: установка хроматического баланса
Тема 1. Работа с кривыми.
1.1 Мастер-канал и мастер-гистограмма
- В каждом из трихроматических каналов изображения (Red, Green, Blue) содержится информация о распределении яркости соответствующего стимула по полю кадра
- Гистограммы для трихроматических каналов строятся на основе содержащихся в них монохромных изображений
- Нормировка гистограмм по высоте делается индивидуально для каждого канала, поэтому масштаб по высоте у них может быть разным
- Мастер-канала (RGB) фактически не существует, это просто кнопка в палитре Channels (Каналы), при нажатии на которую на экран выводится цветное изображение
- Мастер-гистограмма не показывает распределение яркости на изображении, а является графической суммой гистограмме поканальных
- То есть, наличие не мастер-гистограмме столбца, соответствующего определенной яркости, говорит о том, что в изображении содержаться пиксели, имеющие такую яркость в каком-то из каналов
- По краям мастер-гистограммы нельзя судить о самой высокой и самой низкой яркости изображения
- Единственное, что можно сказать по мастер-гистограмме, есть ли в изображении пиксели, имеющие хотя бы в одном из каналов интересующую нас яркость
- Кружок-указатель, перемещающийся по кривой при нажатой кнопке «распальцовки», показывает яркость участка, на который наведен курсор
1. 2 Мастер-кривая, алгоритм работы
2 Мастер-кривая, алгоритм работы
- Мастер-кривая не меняет поканальных кривых, но воздействует на все каналы одновременно, в соответствии со своей формой
- При совместном применении с поканальными кривыми ее действие можно рассматривать как дополнительную коррекцию, применяемую после поканальных кривых
- При этом мастер-гистограмма после воздействия поканальных кривых не изменяется, что может привести к ошибкам при работе с мастер-кривой
1.3 Мастер-кривая, случаи применение
- Мастер-кривую можно применять в тех случаях, когда все каналы изображения необходимо изменить одинаково
- Во-первых, для коррекции яркости и контраста монохромных изображений, когда требуется сохранение нейтральности этих картинок
- Во-вторых, для коррекции яркости и контраста достаточно нейтральных изображений
- Условием достаточной нейтральности является близость тоновых диапазонов, занимаемых значимым объектом во всех каналах, что позволяет накрыть их все одновременно одной S-образной кривой с достаточно узким крутым участком
- В-третьих, для небольшой коррекции яркости любых изображений
- Сильное изменение яркости на достаточно насыщенных изображениях при помощи мастер-кривой приводить не стоит, потому что оно сопровождается сильными изменениями контраста
- Для повышения контраста достаточно насыщенных изображений применять мастер-кривую нельзя, поскольку в разных каналах требуется повышать контраст в разных диапазонах
1. 4 Установка белой, черной и серой точек
4 Установка белой, черной и серой точек
- Изображение является полюноконтрастным в том случае, когда сюжетно-значимая часть изображения занимает весь эффективный тоновый диапазон от границы глубоких теней (10-15 уровней) до границы высоких светов (240-245 уровней)
- В большинстве случаев установка хроматического баланса строится на приведении к нейтральности (серости) объектов, бывшими нейтральными в жизни
- Чтобы быстро решить проблему установки хроматического баланса в светах и тенях совместно с приведением к полноконтрастному виду, вводятся понятия белой, черной и серой точек
- Белая точка — самая светлая нейтральная сюжетно-значимая точка изображения, не являющаяся жестким бликом или источником света
- Черная точка — самая темная нейтральная сюжетно-значимая точка изображения
- Серая точка — область, воспринимавшаяся в жизни нейтральной, и имеющая на фотографии яркость близкую к средней
- Белую и черную точки проще всего искать в режиме отсечки, сдвигая крайние точки кривой с зажатой клавишей Alt.
Делать это лучше всего, подхватив один из маркеров в нижней части кривой
- При работе в режиме отсечки, отсечка происходит независимо в каждом канале, что приводит к появлению насыщенных цветных пятен
- Порядок проявления цветов на этих пятнах показывает, в каком порядке на данных участках распределяются яркости в каналах
- Область, первая пришедшей к белому в режиме отсечки, является наиболее светлой и наиболее близкой к нейтрали. Таким образом, этот участок является потенциальным претендентом на точку белого
- Область, первая пришедшей к черному в режиме отсечки, является наиболее светлой и наиболее близкой к нейтрали. Таким образом, этот участок является потенциальным претендентом на точку черного
- Чаще всего образцом для точки черного являются достаточно глубокие тени
- Быстро установить точки можно при помощи соответствующих пипеток
- Предварительно «белую» пипетку надо настроить: два раза кликните по ней и в появившемся окне задайте яркость 245 в полях R:, G: и B:
- С черной пипеткой проделайте аналогичные действия: два раза кликните по ней и в появившемся окне задайте яркость 10 в полях R:, G: и B:
- Кроме того, чтобы пипетка в выбранной точке замеряла средний цвет изображения, в палитре Options (Параметры) ей нужно задать настройку Sample Size: 5 by 5 Average (Размер образца: Среднее 5х5)
- При необходимости результат работы пипеток можно доработать вручную ориентируясь на внешний вид изображения
- Если после наведения порядка в светах и тенях в картинке сохраняется паразитный оттенок, с ним нужно бороться в средних тонах
Дополнительные материалы:
Андрей Журавлев.
 «Можно ли как-то программно в ФШ найти точку серого на картинке»
«Можно ли как-то программно в ФШ найти точку серого на картинке»Андрей Журавлев. «Цветокоррекция по числам»
Запись мастер-класса «Photoshop — Цветокоррекция по числам»
1.5 Проблемы с определением белой точки
- Основной проблемой при поиске белой точки является необоснованное предположение о нейтральности какого-то светлого объекта
- Чтобы избежать этой проблемы желательно найти несколько претендентов на установку точки белого и сравнить имеющиеся у них оттенки
- Самое главное: после любой операции с кривыми необходимо визуально оценить результат, и если он оказался неудовлетворительным, доработать коррекцию
- Если первоначальное предположение о цвете светлого объекта дает неверный результат, нужно строить другое предположение, приводящее к непротиворечивому результату
- В отсутствии нейтральных объектов хроматический баланс в светах можно устанавливать по светлым объектам имеющим предсказуемый цвет
- Старайтесь не попадать в ловушки ментальных стереотипов: платье невесты, например, не обязательно должно быть белым
Дополнительные материалы:
Андрей Журавлев.
 Калибровать монитор или корректировать «по числам»?
Калибровать монитор или корректировать «по числам»?1.6 Ручная доработка результата работы пипетками
- Если в изображении нет самой светлой нейтральной сюжетно значимой точки, ориентируйтесь на самую светлую сюжетно значимую область с предсказуемым оттенком
- По такой области можно кликнуть белой пипеткой, а после этого придать ей нужный оттенок, возвращая назад светлые точки поканальных кривых
- Белые точки на поканальных кривых нужно возвращать назад чтобы избежать отсечки и эффективно изменить баланс между каналами в светах
- Поскольку возврат белой точки назад приводит к затемнению изображения, для получения нужного оттенка на цветовом круге нужно перемещаться по отрицательным полуосям: Cyan, Magenta, Green
- Таким образом можно понять, в каком канале и насколько сильно нужно двигать кривые
- Оценка результата при возврате оттенка в светлую область производится на глаз
- С точкой черного, как правило, проблема не возникает, потому что нас выручают участки достаточно глубоких теней
- В качестве образца серой точки часто используется белый объект, находящийся в не очень глубокой тени
- При установке серой точки нужно учитывать влияние на цвет объекта со стороны рефлексов и условий освещения
- При доработке результатов установки серой точки средние точки на поканальных кривых нужно двигать навстречу друг другу, чтобы не менялась яркость изображения
- В отсутствии серых маркеров можно пройтись по кривым в каналах и немного «покачать» каждую кривую за центр.
 Если в процессе этого «покачивания» найдется более симпатичный вариант, его можно оставить
Если в процессе этого «покачивания» найдется более симпатичный вариант, его можно оставить - Уменьшение паразитного оттенка в изображении всегда приводит к большему разнообразию оттенков
1.7 Ручная установка белой и черной точек
- Если работа пипетками приводит к потере деталей в светах и/или тенях, от работы пипетками придется отказаться и перейти к ручной установке белой и черной точек
- Для ручной установки точек белого и черного необходимо в каждом канале поставить их на кривой и вручную привести к заданным выходным значениям
- Найдя на изображении точку белого и черного, кликаем по ним с предварительно нажатой кнопкой «распальцовки» и с зажатыми клавишами «Cmd»+«Shift» («Ctrl»+«Shift» на PC)
- У появившихся на поканальных кривых точек в поле Output (Выход) вводим значение 245 для точки белого и 10 для точки черного, значение в поле Input (Вход) не меняем
- Быстрое переключение на соответствующий канал в интерфейсе кривых: RGB — «Opt+2» (на PC «Alt+2»), Red — «Opt+3» (на PC «Alt+3»), Green — «Opt+4» (на PC «Alt+4»), Blue — «Opt+5» (на PC «Alt+5»)
- Быстрое переключение между точками на кривой производится при помощи клавиш «+» и «–»
- Получившаяся в результате кривая имеет более мягкую S-образную форму, которая не создает отсечки в светах и тенях
- Если изображение после ручной установки белой и черной точек дает слишком контрастный вариант, для белой и черной точек значения яркости на выходе можно задать более сильно отличающиеся от крайних.
 Например 235 и 20
Например 235 и 20 - Чтобы каждый тоновый уровень на изображении был задействован, после создания S-образной кривой ее крайние точки можно подтянуть к краю гистограммы
- Если в процессе формальной установки какая-то кривая придет не к S-образной форме, нужно поправить установленные на ней черную и белую точки, чтобы она приобрела единообразный с остальными кривыми, S-образный вид
1.8 Нюансы взаимоотношений с белой и серой точками
- Известное формальное правило «света должны быть теплыми, а тени холодными» является следствием закона Рэлей и выполняется только для сцен, освещенных прямым солнечным светом
- Во всех остальных случаях теплый оттенок на светлых объектах создает ощущение грязи и состаренности материала
- Для придания белым объектам свежести и чистоты хроматический баланс в светах нередко немного сдвигают в прохладную сторону
- Скомпенсировать прохладный оттенок, возникший после установки белой точки, можно при помощи установки точки серого
- Поскольку люди более благосклонно воспринимают теплые картинки, после формальной установки точки серого можно слегка подправить результат в теплую сторону
- В случае режимного света (восход-закат) или близкого к нему, формальная установка серой точки по серому объекту оказывается практически невозможной, из-за явного теплого оттенка света
1. 9 Точная настройка цвета по образцу
9 Точная настройка цвета по образцу
- Точная настройка цвета «по образцу» сводится к приведению имеющихся значений RGB к референсным
- Для этого нужно выбрать характерный участок на образце и замерять имеющиеся в этом месте значения Red, Green, Blue
- После этого на обрабатываемой фотографии находим аналогичный по яркости участок и кликаем по ним с предварительно нажатой кнопкой «распальцовки» и с зажатыми клавишами «Cmd»+«Shift» («Ctrl»+«Shift» на PC)
- У появившихся на поканальных кривых точек в поле Output (Выход) вводим значения измеренные на образце, значение в поле Input (Вход) не меняем
- Поскольку данная коррекция будет действовать на все изображение, для локализации воздействия можно использовать маску
- Если в кадре находятся несколько объектов, а образец и обрабатываемая картинка были сняты с разным светом, каждый цвет потребует индивидуальной коррекции
- Если привести цвет к образцовому нужно на большом количестве фотографий, можно перенастроить серую пипетку, задав значения RGB с образца, и потом кликать ею по участкам аналогичной яркости на обрабатываемых изображениях
- ВНИМАНИЕ!!! После такой работы не забудьте вернуть настройки серой пипетки к исходным
1. 10 Поканальное повышение контраста
10 Поканальное повышение контраста
- Достаточно насыщенные объекты занимают в разных каналах разные тоновые диапазоны, поэтому эффективно поднять их контраст одной кривой невозможно
- Попытка использовать в таком случае S-образную мастер-кривую не приведет к ожидаемому усилению объема, но добавит пережаренности цветам
- Наложение этой кривой в режиме Luminosity (Яркость) удалит изменение хроматики, но даст эффект засеренности
- Повышение яростного контраста, не поддержанное аналогичным изменением хроматизм, прежде всего повышением насыщенности, придает изображению тусклый, засеренный вид
- Для повышения контраста достаточно насыщенных объектов в каждом канале необходимо повышать контраст в том диапазоне, который занимает объект в этом канале
1.11 Выбор диапазонов в каналах
- Если объект окрашен в один цветовой тон, можно поступить аналогично ручной установке белой и черной точек, только в качестве образцов выбирать достаточно светлую и достаточно темную точки объекта
- Найдя на изображении такие точки, кликаем по ним с предварительно нажатой кнопкой «распальцовки» и с зажатыми клавишами «Cmd»+«Shift» («Ctrl»+«Shift» на PC)
- Появившиеся на поканальных кривых точки укажут занимаемые объектом диапазоны
- Если объект окрашен в разные цвета, последовательно переключаемся в интерфейсе кривых на разные каналы и водим по изображению объекта курсором, активировав кнопку «с оттопыренными пальцами»
- Замечаем при этом в каком диапазоне бегает кружок-указатель на кривой, в этом диапазоне и лежит интересующий нас объект
- Переключаться на отображение отдельных каналов в процессе повышения контраста не нужно, это позволяет контролировать вид изображения в процессе работы
- При повышении контраста старайтесь привести крутизну кривых во всех каналах к одинаковой, чтобы на крутых участках кривые были параллельны друг другу
1. 12 Изменения параметров Hue, Saturation и Brightness
12 Изменения параметров Hue, Saturation и Brightness
- Поскольку общая яркость изображение является усреднением поканальных яркостей, после такой операции яркостный контраст будет поднят наилучшим образом
- Такое изменение яростного контраста можно считать однозначно положительным
- Поскольку насыщенность в RGB определяется разницей яркости самого светлого и самого темного каналов, любое повышение контраста приводит к повышению насыщенности за счет увеличения разницы яркости темного и светлого каналов
- Небольшое повышение насыщенности, происходящее при поканальном повышении контраста, поддерживает усиление яростного контраста и не дает картинке засериваться
- В целом повышение насыщенности можно считать положительным, не очень приятно оно может проявляться только на объектах, окрашенных в пастельные тона, например, на коже
- Поскольку при поканальной работе яркости в каналах меняются по разному, в изображение вносится разбаланс по цвету
- Оттенок, вносимый в картинку в результате такого разбаланса, противоположен целевому цвету (цвету объекта, на который мы ориентировались при выборе диапазонов для поканального повышения контраста)
- Оттенок этот добавляется в картинку неравномерно: чем сильнее цвет отличается от целевого, тем сильнее в него добавляется противоположный целевому оттенок
- Это приводит к увеличению разницы между цветами по цветовому тону: все цвета сильнее «разбегаются» от целевого цвета
- На цветных объектах цветовой разбаланс вызывает визуальное ощущение повышения цветовых контрастов
- Усиление цветовых контрастов между цветными объектами чаще всего воспринимается зрителем как улучшение визуального качества изображения, не очень приятно оно может проявляться только на объектах, на которых мы не ожидаем увидеть сильной пятнистости, например, на коже
- На нейтральные объекты разбаланс приносит явный паразитный оттенок, насыщенность которого тем выше, чем сильнее была коррекция
- Появление паразитных оттенков на нейтральных участках практически всегда воспринимается как брак
1. 13 Избавление от негативных последствий коррекции
13 Избавление от негативных последствий коррекции
- Прежде всего необходимо оценить по какому из параметров: цветовой тон (Hue), насыщенность (Saturation) и яркость (Luminosity) изменение картинки можно считать хорошим, а по какому плохим
- Если нас устраивают все изменения — просто оставляем коррекцию как есть
- Если устраивает только повышение яркостного контраста — переключаем корректирующий слой кривых в режим Luminosity (Яркость)
- Помните, что повышение яростного контраста, не поддержанное аналогичным изменением хроматизм, прежде всего повышением насыщенности, придает изображению тусклый, засеренный вид
- Чтобы сохранить повышение яркостного контраста и насыщенности, избежав изменения оттенков — ставим поверх слоя кривых копию исходного изображения и задаем ей режим Hue (Цветовой тон), тем самым восстанавливая цветовой тон исходной картинки
- Если нравится повышение яркостного контраста и сдвиги цвета, но не устраивают повышение насыщенности — ставим поверх слоя кривых копию исходного изображения и задаем ей режим Saturation, тем самым восстанавливая насыщенность исходного изображения
- Такая операция нередко возвращает достаточноую нейтральность близким к нейтрали объектам
- Если этого не произошло, убирать коррекцию с нейтральных областей придется при помощи маски цветовой насыщенности
Для самостоятельного изучения:
Александр Войтехович «Повесть о цветовой насыщенности»
© Андрей Журавлев (aka zhur74), 2012 г.
Редакция третья (2020 г.) переработанная и дополненная.
Первая публикаци https://zhur74.livejournal.com/100178.html
Топ 10 бесплатных сайтов для изучения Adobe Photoshop
Топ 10 бесплатных сайтов для изучения Adobe Photoshop
Adobe Photoshop – профессиональный фоторедактор с богатым набором инструментов и функций для обработки фотографий и создания изображений с нуля. Многообразие функций редактора поражает и позволяет создавать потрясающие воображение картины, однако нужно уметь правильно пользоваться данной программой.
В связи с этим Все Курсы Бай собрал для своих читателей бесплатные сайты, которые помогут научиться пользоваться фотошопом.
photoshop.demiart.ru — сайт собирает со всего интернета уроки Photoshop на русском языке. Данные уроки научат всех желающих рисовать, обрабатывать фотографии и создавать спецэффекты, а также познакомят с секретами компьютерной графики. На сайте можно скачать Photoshop с плагинами, фильтрами, кистями и шрифтами для него.

ВК онлайн – сайт со множеством уроков для поверхностного и углубленного освоения фотошопа. Портал работает с 2017 года. Можно найти интересующие вопросы по поводу использования редактора. Здесь же можно найти учебники, справочные материалы и многое другое.
Globator.net — сайт существует с 2006 года и собрал с того времени множество полезных уроков, которые позволят покорить фотошоп. Приятная особенность для талантливых учеников: сайт часто проводит конкурсы с призами, после конкурса у победителя берут интервью и размешают на сайт.
Photoshop-master.ru – сравнительно молодой, но активно обновляющийся сайт. Здесь есть возможность оформления подписки, после чего дважды в месяц ученики будут получать на бесплатной основе видеоуроки по фотошопу.
 На сайте периодически устраиваются занимательные конкурсы.
На сайте периодически устраиваются занимательные конкурсы.PhotoshopLessons.ru – сайт предоставляет множество бесплатных уроков по программе Adobe Photoshop – затрагивающих от простых основ до тонкостей темы. Есть онлайн-учебник, описание инструментов и фильтров фотошопа. Также здесь можно найти бесплатные курсы и проверить полученные навыки на фотошоп онлайн.
Vse-kusy.com — уроки фотошопа для начинающих. Посетитель получит возможность освоить технику съемки и обработку фото.
Psand.ru — на сайте в наличии инструкции по созданию текстовых эффектов, дизайну, фотообработке, эффектов для фото, полезные видеоуроки. Здесь хранятся учебники и базовые уроки, а также видеокурсы, онлайн-самоучитель и уроки фотошопа CS5 и CS6 на русском языке для простого и эффективного начала освоения редактора.
Англоязычные сайты
Webdesign.org – сайт, представляющий собой электронную библиотеку. Посетители найдут множество различных уроков по теме покорения фотошопа, также есть множество уроков по другим темам.

Psdtuts.com – полезный сайт с уроками. Все они являются авторскими и сделаны профессионалами в ремесле фотошопа. При этом сайт платит приличную сумму за каждый новый авторский урок по Adobe Photoshop. Помимо бесплатных, есть платные курсы по теме.
17 февраля 2017
Система Поиска и Бронирования Туров
Система Поиска и Бронирования Туров
Предложения дня
Показать Все страныВсе городаВсе отели
О системе
Система поиска и бронирования туров «Айти-тур» (IT-tour) — это наиболее простой и удобный инструмент в руках менеджера турагентства, позволяющий в считанные минуты произвести поиск и бронирование самого выгодного для туриста предложения.
Система позволяет осуществлять проверку актуальности туров, наличия мест на чартерные авиарейсы всех основных туроператоров Украины в режиме онлайн.

Обновление данных в режиме реального времени обуславливает максимальную актуальность информации — тот параметр, который для менеджеров турагентств является наиважнейшим при работе с подобными системами.
Система «Айти-тур» позволяет осуществлять прямое бронирование туров и чартерных авиабилетов основных туроператоров Украины прямо из результатов поиска.
Система Айти-тур позволяет продавать и приобретать с аукциона отказные туры.
В системе «Айти-тур» размещены все рекламные туры с выездом из городов Украины.
Система «Айти-тур» позволяет ознакомиться с текущими акциями, проводимыми туроператорами и отелями, проверить историю курсов валют каждого туроператора, пройти обучение, просмотрев вебинары и семинары ведущих туроператоров, воспользоваться многими другими функциями, которые облегчают работу менеджера по туризму.
Система «Айти-тур» ориентирована на украинского пользователя и является лучшей системой поиска и бронирования туров в Украине.
Интерфейс системы настолько прост, что работа в нём не требует специального обучения.
Система «Айти-тур» является условно-бесплатной. Базовая версия предоставляется бесплатно. Оплата берётся только за использование дополнительных сервисов.
Для подключения к системе необходимо пройти несложную процедуру регистрации через 5 минут получить доступ для полнофункциональной работы.
Работа в системе Айти-тур
Мы разработали выносные модули и витрины, которые повышают продажи турагентства в интернете.
 Выносной модуль поиска туров является самым информационноёмким модулем из всех, представленных на рынке Украины. Наш бесплатный модуль можно установить и настроить буквально за 15 минут. Просто прочитайте несложную инструкцию, зарегистрируйтесь, разместите код модуля на вашем сайте и начинайте получать дополнительный доход за счёт интернет-продаж.
Выносной модуль поиска туров является самым информационноёмким модулем из всех, представленных на рынке Украины. Наш бесплатный модуль можно установить и настроить буквально за 15 минут. Просто прочитайте несложную инструкцию, зарегистрируйтесь, разместите код модуля на вашем сайте и начинайте получать дополнительный доход за счёт интернет-продаж.Также мы разработали дополнительные модули и витрины, такие как горящие предложения, витрина туров с минимальными ценами, новый модуль поиска туров, при помощи которых вы в течение нескольких дней сможете создать полноценный сайт турагентств.
Для агентств, у которых пока что нет собственного туристического сайта, мы создали каталог готовых сайтов турагентств, в стоимость которых уже включена годовая подписка на выносные модули. Вам достаточно будет выбрать подходящий дизайн из сотни вариантов – через неделю сайт будет в Вашем распоряжении.

Разработки для сайтов туристических агентств
Менеджеры туристических агентств смогут сравнить ценовые предложения по пакетным и экскурсионным турам, чартерным авиабилетам, рекламно-информационным через поиск туров (более 4 млн операций поиска ежемесячно).
Менеджеры туристических агентств узнают об открытии новых направлений, акциях и уникальных предложениях туристических операторов через баннерную рекламу (сотни тысяч показов в месяц на различных местах).
Конечные потребители (туристы) найдут предложения на выносных модулях поиска, расположенных на 90% сайтов украинских турагентств.

Ознакомиться с более подробным описанием условий интеграции и продвижения операторов в системе Айти-тур можно в презентациях по размещению в системе Айти-тур и баннерная реклама в системе Айти тур.
Айти-тур для туроператоров
Для туроператоров система «Айти-тур» является идеальной рекламной площадкой, позволяющей в одно мгновение донести информацию о турпродукте целевой аудитории (менеджерам турагентств и туристам).
Спасибо за то что воспользовались нашим сервисом
Обзор гипофиза
Основные сведения о гипофизе
- Гормоны гипофиза помогают регулировать функции других желез внутренней секреции.
- Гипофиз состоит из двух частей — передней и задней долей, которые выполняют две совершенно разные функции.
- Гипоталамус посылает сигналы гипофизу, чтобы высвободить или подавить выработку гормонов гипофиза.
Гипофиз часто называют «главной железой», потому что его гормоны контролируют другие части эндокринной системы, а именно щитовидную железу, надпочечники, яичники и семенники. Однако не гипофиз полностью управляет всем.
Однако не гипофиз полностью управляет всем.
Гипофиз составляет всего около 1/3 дюйма в диаметре (то есть размером с горошину) и расположен в основании мозга.
Поскольку их функции настолько взаимосвязаны, неудивительно, что гипоталамус и гипофиз расположены рядом друг с другом.На самом деле они связаны гипофизарной ножкой или, точнее говоря, инфундибулумом.
Гипофиз состоит из передней и задней долей. Передняя доля вырабатывает и выделяет гормоны. Задняя доля не производит гормоны как таковые — это делают нервные клетки в гипоталамусе, — но выпускает их в кровоток.
Гормоны гипофиза
Гормоны гипофиза посылают сигналы другим эндокринным железам, чтобы стимулировать или подавлять их собственное производство гормонов. Например, передняя доля гипофиза вырабатывает адренокортикотропный гормон (АКТГ), чтобы стимулировать выработку кортизола в надпочечниках, когда вы находитесь в состоянии стресса.
Например, передняя доля гипофиза вырабатывает адренокортикотропный гормон (АКТГ), чтобы стимулировать выработку кортизола в надпочечниках, когда вы находитесь в состоянии стресса.
Передняя доля выделяет гормоны при получении высвобождающих или ингибирующих гормонов из гипоталамуса. Эти гормоны гипоталамуса сообщают передней доле, следует ли выделять больше определенного гормона или прекратить производство гормона.
Гормоны передней доли:
- Адренокортикотропный гормон (АКТГ): АКТГ стимулирует выработку гормонов надпочечниками.
- Фолликулостимулирующий гормон (ФСГ): ФСГ работает с ЛГ, обеспечивая нормальное функционирование яичников и яичек.
- Гормон роста (GH): GH необходим в ранние годы для поддержания здорового телосложения и роста у детей. У взрослых он способствует здоровью костной и мышечной массы и влияет на распределение жира.
- Лютеинизирующий гормон (ЛГ): ЛГ работает с ФСГ, обеспечивая нормальное функционирование яичников и яичек.

- Пролактин : пролактин стимулирует выработку грудного молока.
- Тиреотропный гормон (ТТГ): ТТГ стимулирует выработку гормонов щитовидной железой.
Задняя доля содержит концы нервных клеток, идущих от гипоталамуса. Гипоталамус посылает гормоны непосредственно в заднюю долю через эти нервы, а затем гипофиз высвобождает их.
Гормоны задней доли:
- Антидиуретический гормон (АДГ): Этот гормон побуждает почки увеличивать абсорбцию воды в крови.
- Окситоцин: Окситоцин участвует в различных процессах, таких как сокращение матки во время родов и стимуляция выработки грудного молока.
Опухоли гипофиза — наиболее распространенное заболевание гипофиза, и они есть у многих взрослых. Однако в большинстве случаев они не опасны для жизни. Но это не значит, что они безвредны — опухоли гипофиза могут нарушить нормальную способность железы выделять гормоны.
Есть два типа опухолей гипофиза — секреторные и несекреторные. Секреторные опухоли выделяют слишком много гормона, а несекреторные опухоли не выделяют избыток гормона.
Эти гормональные нарушения могут вызывать проблемы во многих областях тела. Например, если у вас секреторная опухоль, которая сверхпродуцирует тиреотропный гормон, у вас может развиться гипертиреоз.
Другое заболевание гипофиза, известное как апоплексия гипофиза.В некоторых случаях функция гипофиза может быть внезапно нарушена (из-за кровотечения или травмы), создавая опасную для жизни нехватку жизненно важных гормонов.
Если вы считаете, что у вас проблемы с гипофизом, вам следует поговорить с эндокринологом. Он или она поможет диагностировать и лечить ваше гормональное заболевание.
Гипофиз чрезвычайно важен для общей функции вашей эндокринной системы — и для вашего общего состояния здоровья. Работая с гипоталамусом, гипофиз обеспечивает правильную работу всех внутренних процессов вашего тела.
Обновлено: 10.04.18
Диагностика опухолей гипофиза
Гипофиз | Вы и ваши гормоны от Общества эндокринологов
Альтернативные названия
Гипофиз
Где мой гипофиз?
Компьютерное изображение головы человека, изображающее левое полушарие мозга внутри. Выделенная область (в центре) показывает гипофиз, прикрепленный к нижней части гипоталамуса у основания мозга.
Гипофиз — это небольшая железа, которая находится в турецком седле («турецкое седло»), костной впадине в основании черепа, под мозгом и за переносицей . Гипофиз состоит из двух основных частей: передней доли гипофиза и задней доли гипофиза. Железа прикреплена к части мозга (гипоталамус), которая контролирует ее деятельность. Передняя доля гипофиза связана с мозгом короткими кровеносными сосудами.Задний гипофиз на самом деле является частью мозга и выделяет гормоны прямо в кровоток под управлением мозга.
Что делает мой гипофиз?
Гипофиз называют «главной железой», поскольку вырабатываемые им гормоны контролируют множество различных процессов в организме. Он определяет потребности организма и посылает сигналы различным органам и железам по всему телу, чтобы регулировать их функции и поддерживать соответствующую среду. Он выделяет в кровоток различные гормоны, которые действуют как посланники для передачи информации от гипофиза к отдаленным клеткам, регулируя их активность.Например, гипофиз вырабатывает пролактин, который воздействует на грудь, вызывая выработку молока. Гипофиз также выделяет гормоны, которые действуют на надпочечники, щитовидную железу, яичники и семенники, которые, в свою очередь, производят другие гормоны. Через секрецию своих гормонов гипофиз контролирует обмен веществ, рост, половое созревание, размножение, кровяное давление и многие другие жизненно важные физические функции и процессы.
Какие гормоны вырабатывает мой гипофиз?
Передняя доля гипофиза вырабатывает и выпускает в кровоток следующие гормоны:
- адренокортикотропный гормон, который стимулирует надпочечники секретировать стероидные гормоны, в основном кортизол
- гормон роста, регулирующий рост, обмен веществ и состав тела
- лютеинизирующий гормон и фолликулостимулирующий гормон, также известный как гонадотропины.
 Они действуют на яичники или семенники, стимулируя выработку половых гормонов и созревание яйцеклеток и сперматозоидов
Они действуют на яичники или семенники, стимулируя выработку половых гормонов и созревание яйцеклеток и сперматозоидов - пролактин, стимулирующий производство молока
- гормон, стимулирующий щитовидную железу, который стимулирует выработку гормонов щитовидной железы в щитовидной железе.
Каждый из этих гормонов производится клетками отдельного типа в гипофизе, за исключением фолликулостимулирующего гормона и лютеинизирующего гормона, которые вырабатываются одной и той же клеткой.
Два гормона вырабатываются гипоталамусом и затем накапливаются в задней доле гипофиза, прежде чем попасть в кровоток.Это:
- антидиуретический гормон (также называемый вазопрессином), контролирующий водный баланс и артериальное давление
- окситоцин, который стимулирует сокращения матки во время схваток и секрецию молока во время грудного вскармливания.
Между передним и задним гипофизом находится промежуточный гипофиз. Ячейки здесь производят:
Ячейки здесь производят:
- меланоцит-стимулирующий гормон, который действует на клетки кожи, стимулируя выработку меланина.
Что может пойти не так с моим гипофизом?
Гипофиз — важная железа в организме, и вырабатываемые ею гормоны выполняют разнообразные задачи и регулируют функции многих других органов. Это означает, что симптомы, возникающие при прекращении правильной работы гипофиза, могут быть разными в зависимости от того, какой гормон поражен.
Состояния, которые напрямую влияют на гипофиз, можно разделить на три основные категории:
- Состояния, при которых гипофиз вырабатывает слишком много одного или нескольких гормонов.Примеры включают акромегалию, болезнь Кушинга и пролактиному.
- Заболевания, при которых гипофиз вырабатывает слишком мало одного или нескольких гормонов. Примеры включают дефицит гормона роста у взрослых, несахарный диабет ‘data-content =’ 1239 ‘> несахарный диабет и гипопитуитаризм.

- Заболевания, изменяющие размер и / или форму гипофиза. Примеры включают синдром пустого турецкого седла.
Клеточный тип может делиться, а затем образовывать небольшой доброкачественный узелок, известный как опухоль, и в этом случае пациент может страдать от воздействия слишком большого количества гормона, производимого клеткой.Если опухоль становится очень большой, даже если она остается доброкачественной, она может раздавить окружающие клетки и остановить их работу (гипопитуитаризм) или подтолкнуть вверх и нарушить зрение — дефект поля зрения. В очень редких случаях опухоль может расширяться в сторону и вызывать двоение в глазах, так как поражаются нервы, контролирующие движения глаз. Следует подчеркнуть, что даже когда эти опухоли большие, они очень редко распространяются на другие части тела.
Последний раз рассмотрено: фев 2018
Что это такое и определение
Что такое гипофиз?
Гипофиз (гипофиз) — это эндокринная железа размером с горошину, расположенная в основании вашего мозга, за переносицей и непосредственно под гипоталамусом. Он находится в углублении клиновидной кости, которое называется турецким седлом. Гипофиз — одна из восьми взаимосвязанных основных эндокринных желез:
Он находится в углублении клиновидной кости, которое называется турецким седлом. Гипофиз — одна из восьми взаимосвязанных основных эндокринных желез:
- Шишковидная железа.
- Гипофиз.
- Щитовидная железа.
- Тимус.
- Надпочечник.
- Поджелудочная железа.
- Яичник (только для женщин).
- Яичко (только для мужчин).
Гипофиз часто называют «главной железой», потому что он не только секретирует свои собственные гормоны, он приказывает другим железам вырабатывать гормоны.
Гипофиз разделен на две основные части: переднюю (переднюю) долю и заднюю (заднюю) долю. Гипоталамус и гипофиз соединяет стебель кровеносных сосудов и нервов. Через эту ножку гипоталамус сообщается с передней долей через гормоны, а с задней — посредством нервных импульсов.
Гипоталамус, расположенный над гипофизом, является центром управления некоторыми основными операциями вашего тела. Он отправляет сообщения вегетативной нервной системе вашего тела, которая контролирует такие вещи, как артериальное давление, частоту сердечных сокращений, дыхание, температуру тела, цикл сна-бодрствования и пищеварение. Гипоталамус также заставляет гипофиз производить и выделять гормоны.
Гипоталамус также заставляет гипофиз производить и выделять гормоны.
Что делает гипофиз?
Железы — это органы, которые выделяют гормоны — «химические посланники» тела, которые перемещаются через кровоток к разным клеткам, сообщая им, что делать. Основными гормонами, вырабатываемыми гипофизом, являются:
- АКТГ: адренокортикотропный гормон. Стимулирует выработку кортизола, «гормона стресса», который поддерживает кровяное давление и уровень сахара в крови.
- ФСГ: Фолликулостимулирующий гормон. Способствует выработке спермы и стимулирует выработку эстрогена яичниками.
- LH: лютеинизирующий гормон. Стимулирует овуляцию у женщин и выработку тестостерона у мужчин.
- GH: гормон роста. Помогает поддерживать здоровье мышц и костей и управлять распределением жира.
- PRL: Пролактин. Вызывает выработку грудного молока после родов. Он также влияет на гормоны, контролирующие яичники и яички, что может влиять на менструальный цикл, сексуальные функции и фертильность.
- ТТГ: тиреотропный гормон. Стимулирует работу щитовидной железы, регулирующую обмен веществ, энергию и нервную систему.
- Окситоцин: способствует прогрессированию родов, вызывает выделение грудного молока, влияет на роды, грудное вскармливание, поведение и социальное взаимодействие, а также на связь между матерью и ребенком.
- АДГ: антидиуретический гормон или вазопрессин. Регулирует водный баланс и уровень натрия.
Гормоны не выделяются из гипофиза в постоянном потоке.Они приходят всплесками, каждые один-три часа, и чередуются между периодами активности и периодами бездействия.
Что происходит, если гипофиз не работает должным образом?
Ваш гипофиз играет настолько важную роль, что многое может пойти не так, если он чрезмерно производит гормоны (гиперпитуитаризм) или недостаточно производит гормоны (гипопитуитаризм). Перепроизводство или недопроизводство могут повлиять на обмен веществ, рост, кровяное давление, половые функции и многое другое.
Заболевания гипофиза возникают, когда гипофиз не может нормально функционировать, вероятно, из-за опухоли, которая представляет собой аномальный рост клеток.Эксперты-эндокринологи определили, что примерно у каждого пятого человека возникает опухоль гипофиза (от 16% до 20% населения). К счастью, опухоли обычно доброкачественные. Рак гипофиза случается редко. Иногда в гипофизе годами может быть даже доброкачественная опухоль, не вызывающая никаких симптомов.
Есть два типа опухолей: функционирующие и нефункционирующие. Функционирующая опухоль сама производит гормоны, а нефункционирующая опухоль — нет.Чаще встречаются нефункционирующие опухоли.
Если у вас опухоль, обратитесь к эндокринологу, специалисту по гипофизу. Вам также может потребоваться посещение офтальмолога (глазного врача) и нейрохирурга (хирурга, который оперирует мозг, голову и нервную систему).
Каковы симптомы опухоли гипофиза?
Многие симптомы могут указывать на опухоль гипофиза. Если опухоль оказывает давление на железу, ваши симптомы могут включать:
- Головные боли.
- Проблемы со зрением (включая проблемы с периферическим зрением).
Если гипофиз не производит достаточного количества гормонов, ваши симптомы могут включать:
- Усталость.
- Головокружение.
- Сухая кожа.
- Нерегулярные месячные (женщины).
- Сексуальные симптомы (мужчины).
Дополнительные симптомы включают:
- Изменения настроения.
- Раздражительность.
- Мышечная слабость.
- Депрессия.
- Изменения менструального цикла.
- Эректильная дисфункция.
- Бесплодие.
- Несоответствующий рост груди.
- Несоответствующее производство грудного молока.
Есть несколько состояний, которые затрагивают гипофиз:
- Гипопитуитаризм: гипопитуитаризм — это когда гипофиз не вырабатывает достаточное количество гормонов.
- Акромегалия (гигантизм): гигантизм — очень редкое заболевание, вызываемое выработкой гипофизом слишком большого количества гормона роста (GH).
- Несахарный диабет: это заболевание, на которое влияет вазопрессин, антидиуретический гормон (АДГ). Если у вас это заболевание, ваши почки не могут удерживать воду, что приводит к учащенному мочеиспусканию и усилению жажды.
- Гипогонадизм: Это состояние, также известное как дефицит тестостерона, представляет собой неспособность яичек вырабатывать тестостерон и / или сперму.
- Пролактинома: это тип опухоли, при которой гипофиз вырабатывает слишком много гормона пролактина.
- Галакторея: Галакторея — это когда мужчина или женщина вырабатывают грудное молоко, когда они не кормят грудью.
- Синдром Кушинга: это редкое заболевание может возникнуть, когда ваше тело вырабатывает слишком много АКТГ, в результате чего другая железа в организме, надпочечники, вырабатывает слишком много кортизола. Это состояние может поражать практически любую ткань тела.
- Синдром дефицита GH у взрослых: проблемы, возникающие в результате этого синдрома, включают изменения в составе тела из-за изменений жира и мышц, уровня плохого холестерина и потери энергии и / или интереса к хобби и общественной деятельности.
- Синдром пустого турецкого седла: турецкое седло — это костная структура, которая окружает и защищает гипофиз. Синдром пустого турецкого седла означает, что сначала ничего не находится внутри этой костной структуры. Гипофиз может быть плоским, меньше обычного или регрессировать в полости из-за травмы.
- Синдром Шихана (послеродовой гипопитуитаризм): синдром Шихана возникает при сильном маточном кровотечении во время родов. Такая сильная кровопотеря приводит к гибели некоторых тканей гипофиза.
- Краниофарингиома: краниофарингиома — это редкая опухоль, которая оказывает давление на гипоталамус.
- Множественная эндокринная неоплазия (МЭН): МЭН вызывает развитие опухолей нескольких желез.
- Лимфоцитарный гипофизит: вызывается иммунными клетками, которые вызывают воспаление гипофиза.
Как лечат опухоль гипофиза?
Для лечения опухоли гипофиза может потребоваться лучевая терапия, лекарства и хирургическое вмешательство.
- Радиотерапия — которая может проводиться до или вместо операции — использует высоко сфокусированное рентгеновское излучение (гамма-нож или линейный ускоритель рентгеновского ножа), обычно в течение нескольких недель.
- Лекарства используются либо для снижения уровня определенного гормона, либо для замены гормона, который вырабатывается недостаточно.
- Операция называется транссфеноидальной операцией, при которой нейрохирург делает разрез внутри вашей ноздри или под верхней губой. После удаления опухоли вы пробудете в больнице около пяти дней. Время восстановления варьируется. Это может быть от четырех до восьми недель. Требуются регулярные наблюдения.
Опухоли гипофиза могут снова расти.
Ваш гипофиз влияет на жизненно важные области вашего тела. Если ваш гипофиз не функционирует должным образом, это может отрицательно повлиять на вашу кожу, мозг, репродуктивные органы, зрение, настроение, энергию, рост и многое другое. Ваше тело зависит от гормонов, которые оно производит и выделяет.
Обратитесь к своему врачу, чтобы устранить любые симптомы, которые могут указывать на ваш гипофиз.
границ | Молекулярные механизмы действия ФСГ
Введение
Фолликулостимулирующий гормон (ФСГ) — это гликопротеин, играющий центральную роль в воспроизводстве и развитии млекопитающих.В яичнике ФСГ регулирует фолликулогенез, отбор ооцитов и синтез половых стероидных гормонов, тем самым подготавливая репродуктивный тракт к оплодотворению, имплантации и беременности (1). У мужчин этот гонадотропин опосредует развитие яичек и сперматогенез (2). Гормон секретируется гонадотропными клетками гипофиза при пульсирующей регуляции гипоталамического гонадотропин-рилизинг-гормона (ГнРГ) (3) и действует на поверхности клеток-мишеней, расположенных в гонадах как мужчин, так и женщин, где гормон — инициируются сигналы, связанные с пролиферацией клеток и апоптозом.ФСГ отображает α-субъединицу, общую для других гонадотропинов и тиреотропина, и β-субъединицу, специфически связывающуюся с его рецептором, связанным с G-белком (GPCR), а именно FSHR (4). In silico и кристаллографический структурный анализ также обнаружили взаимодействие между субъединицей α и FSHR, демонстрируя, что связывание рецептора не исключает субъединицу β (5). Связывание гормонов подразумевает конформационные изменения рецептора (6), которые передают сигнал через прямые взаимодействия белков на плазматической мембране, что приводит к каскаду биохимических реакций, которые составляют переплетенную сложную сигнальную сеть (7).В этом обзоре подробно обсуждаются сигнальные пути, активируемые в клетках гонад при связывании ФСГ с его мембранным рецептором, что дает всестороннее представление о последующих сигналах жизни и смерти, регулирующих репродуктивные функции.
Взаимодействие FSHR с мембранными рецепторами
Было показано, что FSHR функционально и / или физически взаимодействует с другими мембранными рецепторами (8, 9), тем самым усиливая разнообразие действия FSH (10). Например, FSHR может существовать как единица ди / тримерных гомомеров (5).Интересно, что гетеродимеризация FSHR с рецептором лютеинизирующего гормона (LH) (LHCGR) (11) может играть ключевую роль в регулировании роста и отбора яичников (12) благодаря физическому взаимодействию между этими двумя рецепторами. Интересно, что внутриклеточные сигналы, доставляемые LH в LHCGR, могут модулироваться присутствием FSHR на поверхности клетки, и , наоборот, , посредством образования гетеромеров рецептора. Например, несвязанный коэкспрессируемый FSHR усиливает Gαq-опосредованную передачу сигналов, инициированную LHCGR (13), тогда как LHCGR может ингибировать FSHR-зависимую продукцию цАМФ (11).Кроме того, другие классы рецепторов, такие как рецепторы тирозинкиназы, также могут вносить вклад в модуляцию активности FSHR. Рецептор инсулиноподобного фактора роста-1 (IGF-1R) является одним из них, поскольку он необходим для дифференцировки клеток гранулезы, индуцированной ФСГ, через сигнальный каскад с участием гомолога 3 вирусного онкогена тимомы (AKT3) (14). Точно так же действие рецептора эпидермального фактора роста (EGFR) во время дифференцировки гранулезных клеток необходимо для активации ERK1 / 2 (15).Интересно, что взаимодействие между сигнальными сетями FSHR и EGFR было проанализировано с использованием автоматизированного, основанного на логике подхода, предполагающего, что путь ERK1 / 2 может быть активирован EGFR-зависимыми сигналами через митоген-активируемые протеинкиназы p38 (MAPK) ( 16). Более того, это исследование подтвердило, что EGFR трансактивируется посредством FSHR-опосредованных путей с участием протоонкогена тирозин-протеинкиназы SRC . С другой стороны, сигнальная сеть EGFR перекрывает, по крайней мере частично, сеть FSHR, способствуя модуляции ERK1 / 2, фосфатидилинозитол-4,5-бисфосфат-3-киназы (PI3K) / протеинкиназы B (AKT), и киназа Януса (JAK) / сигнальный преобразователь и активатор путей транскрипционного белка (STAT) (16).
Партнеры по передаче внутриклеточного сигнала FSHR
Как правило, G-белки непосредственно активируются FSHR путем отщепления димера βγ от α-субъединицы (17), которые действуют как регуляторы внутриклеточных ферментов, таких как G-протеиновые рецепторные киназы (GRK) или аденилилциклаза, соответственно, среди многих других (18). Более того, было продемонстрировано, что димер βγ способен модулировать внутриклеточные сигнальные каскады (19, 20).
Активация белкаG сопровождается фосфорилированием FSHR на внутриклеточном уровне, управляемым GRK и приводящим к ассоциации рецептора с β-аррестинами (21, 22).β-аррестины представляют собой каркасные белки (23), которые опосредуют десенсибилизацию GPCR, рециклинг и независимую от G-белка передачу сигналов (24). Другим прямым партнером, взаимодействующим с FSHR, является адаптерный белок, фосфотирозин, взаимодействующий с доменом PH и лейциновой застежкой-молнией 1 (APPL1), который связан с активацией антиапоптотического пути PI3K / AKT и мобилизацией ионов кальция (25). Таким образом, APPL1 может регулировать выбор доминантного фолликула, опосредуя антиапоптотические эффекты, проявляемые FSH посредством ингибирующего фосфорилирования гомолога вилки при рабдомиосаркоме (FOXO1a) (26).Интересно, что APPL1 участвует в передаче сигналов цАМФ, осуществляемой активностью GPCR в очень ранних эндосомных компартментах, тем самым внося вклад в пространственное кодирование внутриклеточной передачи сигналов, как показано для LHR (27). Точно так же взаимодействующий с GAIP белок C-конец (GIPC), белок PDZ, перенаправляет FSHR в преранние эндосомы, тем самым способствуя устойчивому внутриклеточному MAPK (28). Другой белок, напрямую взаимодействующий с FSHR, — это адаптерный белок 14-3-3τ (29), который может связываться с сайтом взаимодействия канонического G-белка с рецептором, расположенным на внутриклеточном уровне, и опосредует активацию AKT-пути (30).
В гонадах опосредованная ФСГ передача сигналов приводит к транскрипции генов-мишеней, которые включают LHCGR и другие гены, кодирующие мембранные рецепторы, протеинкиназы, факторы роста, ферменты, регулирующие синтез стероидов, гены, участвующие в регуляции клеточного цикла, пролиферацию а также дифференцировка, апоптоз и циркадный ритм (31–33). Несмотря на широкое разнообразие генов-мишеней ФСГ, эффекты стимуляции гонад гормоном были определены как пролиферативные и антиапоптотические из-за положительного влияния на гаметогенез (34, 35) и на рост некоторых раковых клеток (36).Тем не менее проапоптотические функции возникли как состояние, связанное с производством стероидов, опосредованным ФСГ (37, 38). В этом обзоре обсуждаются молекулярные механизмы действия ФСГ и их взаимосвязь с последующими стероидогенными сигналами, сигналами жизни и смерти, регулирующими репродуктивную функцию (рис. 1).
Рисунок 1 . Перекрестное взаимодействие между ФСГ-зависимыми стероидогенными сигналами, сигналами жизни и смерти в клетках гранулезы. Субъединицы G-белка и β-аррестины опосредуют активацию множества сигнальных путей, модулирующих различные события ниже по течению.Передача сигналов, связанных с белком Gαs / цАМФ, представлена оранжевыми стрелками, в то время как каскады передачи сигналов, зависящие от других внутриклеточных взаимодействиях FSHR, показаны синими стрелками. Стероидогенные события в основном опосредуются через путь цАМФ / PKA, который связан с передачей сигналов p38 MAPK, в то время как ERK1 / 2 и AKT являются ключевыми участниками для активации митогенных сигналов и сигналов выживания. Некоторые пути были опущены.
Активация стероидогенного пути цАМФ / PKA
Хотя в основном известно, что ФСГ поддерживает созревание гамет посредством функций питания клеток Сертоли у мужчин, гормон обладает стероидогенной активностью в отношении клеток гранулезы яичников (4).Это действие осуществляется через путь протеинкиназы A (PKA), активация которого зависит от превращения АТФ во второй мессенджер цАМФ аденилатциклазами, первичными мишенями белковой субъединицы Gαs. Взаимодействие между цАМФ и ПКА было описано несколько десятилетий назад (39). Увеличение внутриклеточного цАМФ находится под отрицательным контролем ферментов фосфодиэстеразы (ФДЭ), которые метаболизируют второй мессенджер в 5’АМР (40). Как упоминалось выше, передача сигналов цАМФ пространственно и временно разделена внутри клетки (41).Универсальность цАМФ-зависимой передачи сигналов зависит от экспрессии таких факторов, как изоформа аденилатциклазы (42), PDE (43), β-аррестины (44) и закрепляющие белки A-киназы (AKAP) (45), которые нацелены на субклеточные распространение PKA.
В клетках Сертоли связывание цАМФ с PKA приводит к высвобождению каталитических субъединиц PKA (46) и косвенно опосредует фосфорилирование MAPK киназы 1/2 (ERK1 / 2), регулируемой внеклеточными сигналами, чтобы способствовать пролиферации клеток (47). ).В клетках гранулезы механизм, посредством которого активируется ERK, вероятно, состоит в снятии тонического ингибирования, оказываемого фосфотирозинфосфатазой на MEK1 (48), недавно идентифицированный как DUSP6 (49). Альтернативный механизм заключается в активации ERK1 / 2 β-аррестинами с кинетикой, отличной от G-белков (рис. 2), поскольку она задерживается и сохраняется (50). Было продемонстрировано, что pERK1 / 2 участвует как в цАМФ-зависимом (51), так и в -независимом (52) стероидогенезе. В первом случае истощение фосфорилирования ERK1 / 2 за счет специфического ингибирования MEK привело к ослабленному раннему (10-15 мин) фосфорилированию белка, связывающего элемент ответа цАМФ (CREB) (51), ядерного фактора транскрипции, активирующего стероидогенные ферменты. в клетках гонад (53).В этом случае ингибирование pERK1 / 2 отрицательно влияет на синтез прогестерона, указывая на то, что цАМФ-зависимое фосфорилирование ERK1 / 2 играет стимулирующую роль в быстро доставляемом ФСГ-зависимом стероидогенном сигнале. Интересно, что молекулярные механизмы, регулирующие стероидогенные стимулы в клетках Лейдига, могут отличаться от тех, которые возникают в чувствительных к ФСГ клетках. В клетках Лейдига стероидные гормоны могут продуцироваться посредством ERK1 / 2- и CREB-зависимой передачи сигналов в отсутствие рекрутирования цАМФ, посредством механизма, регулируемого EGFR (52).В клетках гранулезы избирательная блокада активации MAPK приводит к ингибированию ФСГ-зависимого StAR и синтеза прогестерона, в то время как превращение андрогенов в эстроген ферментом ароматазой усиливается (54), демонстрируя дифференциальную регуляцию индуцированного ФСГ синтеза половых стероидов в клетках-мишенях. . Аналогичные результаты были получены при обработке клеток теки ЛГ, который индуцировал дифференциальную, ERK1 / 2-зависимую регуляцию выработки прогестерона и андрогенов (55). Тем не менее, роль ERK1 / 2 в опосредовании стероидогенеза все еще обсуждается, поскольку сообщалось, что он является ингибирующим (56), в то время как другие исследования продемонстрировали положительное влияние активации MAPK на синтез половых стероидов (57).
Рисунок 2 . Временная последовательность ФСГ-зависимых событий по пути цАМФ / ПКА. Связанная с цАМФ передача сигналов включает активацию PKA, ERK1 / 2 и CREB. Фосфорилирование FSHR с помощью GRK происходит до рекрутирования β-аррестина и последующей интернализации рецептора.
Роль цАМФ-зависимой активации PKA
Принимая во внимание, что ERK является непрямой цитозольной мишенью PKA, которая может влиять на фосфорилирование CREB (51), последнее может непосредственно активироваться при транслокации каталитической субъединицы PKA в ядро (48), тем самым вызывая транскрипцию генов-мишеней CREB, характеризующихся цАМФ. -ответные элементы (CRE) в их промоторной области (53).Было также показано, что ядерная PKA фосфорилирует гистон h4, таким образом опосредуя митогенную активность ФСГ в клетках гранулезы (58, 59). Эти интересные наблюдения предполагают, что PKA может играть более общую роль в транскрипции генов, способствуя ремоделированию хроматина посредством посттрансляционных модификаций гистона h4. Кроме того, недавние полногеномные эксперименты показали, что чувствительные к ФСГ гены содержат гораздо меньше CRE , чем ожидалось, в их промоторах, которые заметно обогащены сайтами связывания GATA (32).
Широкий спектр PKA-зависимых сигнальных путей предполагает, что киназа является главным регулятором нескольких FSH-зависимых клеточных функций, особенно связанных со стероидогенезом и дифференцировкой клеток. Однако внутриклеточные сигнальные каскады, регулируемые PKA, не полностью перекрывают каскады, зависящие от ФСГ. Например, FSH индуцирует активацию p38 MAPK, в то время как PKA per se — нет (60).
ФСГ-индуцированная продукция цАМФ не только приводит к активации PKA, но также и обменного белка, непосредственно активируемого активацией цАМФ (EPAC).EPAC является относительно недавно обнаруженной мишенью цАМФ, опосредующей активацию малых GTPases RAS и RAP и приводящей к регуляции нескольких функций клетки, таких как активация митоген-активируемой протеинкиназы, изменения цитоскелета и гомеостаз кальция (61). Было высказано предположение, что EPAC является модулятором экспрессии EGFR (62) и дифференцировки гранулезных клеток (15) в яичнике, а также фосфорилирования AKT в клетках Сертоли (63). Однако роль EPAC в сигнальном каскаде, опосредованном FSH, еще полностью не выяснена.
Регуляция пролиферативных и проапоптотических сигналов
В клетках гонад часть стероидогенного процесса и протеасома разделены на разные органеллы, что позволяет избежать коллапса клеток до выработки адекватного количества половых стероидных гормонов (64). Эта функция, вероятно, позволяет ограничить количество фолликулов, которые могут достичь овуляции, и поддерживать синтез половых стероидов на начальных этапах апоптоза. Эти проблемы отражают связь между внутриклеточными сигнальными каскадами, регулирующими стероидогенные сигналы, и проапоптотическими стимулами, доминирование которых зависит от стадии, зависит от нескольких паракринных факторов и регулируется через сложной внутриклеточной сети, включающей цАМФ и активирующей проапоптотический белок p53. (65).В этом контексте связь между активацией cAMP / PKA и p38 MAPK может обеспечивать молекулярный механизм апоптоза в стероидогенных клетках. Роль p38, а также Jun N-терминальной киназы (JNK) связана с апоптотическими событиями в преовуляторных гранулезных клетках приматов (66), предполагая, что эти ферменты могут участвовать в отборе доминантного фолликула. Этой роли будет противодействовать активация pERK1 / 2 в доминантном фолликуле (57), подтверждая антиапоптотические и пролиферативные функции, опосредованные этой MAP-киназой.Действительно, гибель гранулезных клеток яичников связана со снижением активности ERK1 / 2, что связано с фосфорилированием BCL-2-ассоциированного белка агониста клеточной смерти (BAD), что приводит к потере его проапоптотической активности (67, 68).
Про- и антиапоптотические пути активируются одновременно
В стероидогенных клетках апоптозу предшествует округление клеток, цАМФ-зависимые конформационные изменения, включающие разрушение актиновых филаментов (69, 70), которые можно предотвратить селективной блокадой PKA, а также зависит от p38 MAPK (71).И PKA, и p38 MAPK могут активироваться ФСГ дозозависимым образом, что приводит к перестройке цитоскелета и изменениям формы. Эти данные предполагают, что гонадотропин сохраняет как про-, так и антиапоптотический потенциал, проявляя vi a p38 MAPK и ERK1 / 2, соответственно, и это двойное действие ФСГ дает интересную точку зрения на функционирование гонадотропина. С одной стороны, гормон индуцирует синтез стероидных гормонов через путь цАМФ / PKA, что является необходимым условием для роста и размножения гамет (72).Однако каскад стероидогенных сигналов перекрестно связан с проапоптотическими сигналами, происходящими через p38 MAPK, активируемыми одновременно и необходимыми для регуляции синтеза стероидов (73, 74). Этот перекрестный обмен был описан даже в линии клеток Y1 надпочечников мыши, где активация p38 MAPK отрицательно влияет на фосфорилирование CREB и активность StAR, ингибируя синтез стероидов, индуцированный ФСГ (75). С другой стороны, сигналы выживания передаются через сигнальный пакет PKA / ERK1 / 2, уравновешивая проапоптотический эффект и, в определенной степени, даже подавляя стероидогенез (56).Хотя для полного решения этого вопроса необходимо предпринять дальнейшие усилия, некоторые намеки предполагают, что ФСГ-зависимый молекулярный механизм, лежащий в основе клеточной судьбы, может зависеть от эффективности и устойчивости цАМФ на внутриклеточных уровнях. Действительно, пролиферативные сигналы могут преобладать при относительно низких уровнях экспрессии FSHR (38) из-за преимущественной активации передачи сигналов ERK1 / 2 через β-аррестины (38, 76). Относительно высокие и постоянные уровни внутриклеточного цАМФ из-за истощения β-аррестина или сверхэкспрессии FSHR приводят к расщеплению каспазы 3 и апоптозу (38), и этот механизм может способствовать регулированию отбора доминантных фолликулов яичников (12).В клетках гранулезы сверхэкспрессия FSHR связана с активацией проапоптотических генов и повышенной гибелью клеток по сравнению с клетками, экспрессирующими относительно низкие уровни FSHR (77). Таким образом, возможно, что пролиферативные сигналы, передаваемые через путь ERK1 / 2, могут быть недостаточными для противодействия проапоптотическому стимулу во время ранней / средней антральной фолликулярной фазы, когда экспрессия FSHR достигает максимальных уровней (78). В яичнике эта ситуация должна быть динамичной и преходящей, так же как и сверхэкспрессия FSHR (78), фолликул-специфичная и стадийно-зависимая, чтобы координировать созревание одного фолликула, достигающего овуляции, в то время как другие становятся мансарда .Этот регуляторный механизм может быть сопоставлен с тем, что было ранее описано для клетки Сертоли, которая, как предполагается, является мужским аналогом гранулезной клетки. В 5-дневных клетках Сертоли крысы путь ERK1 / 2 стимулируется ФСГ при двойном связывании ФСГР как со стимулирующими Gα, так и с ингибирующими Gαi белками, что приводит к активации циклина D1 и пролиферации клеток (47). По мере прохождения клетками программы дифференцировки лечение ФСГ связано с последовательным ингибированием ERK1 / 2 и снижением пролиферации клеток при постепенной стабилизации PTEN (79).Таким образом, сигнальный путь ERK1 / 2 является ключевым регулятором индуцированных ФСГ сигналов жизни и смерти.
Сигнализация PKC и ионов кальция
Все больше данных указывает на то, что одно из действий, оказываемых ФСГ, заключается в активации пути протеинкиназы C (PKC), который участвует в расширении кумулюса, мейотическом созревании ооцитов и модуляции выработки прогестерона в яичниках (80). . Перекрестная связь между цАМФ / PKA и путями PKC была также описана в клетках Сертоли (81), где ФСГ-зависимая активация этих киназ связана с передачей сигналов иона кальция (Ca 2+ ) (82), возникающей в результате внутриклеточного высвобождения. а также от быстрого притока из каналов Ca 2+ Т-типа (83, 84) или посредством взаимодействия Gαh трансглутаминаза / PLCδ (85). Эксперименты in vitro с временно сверхэкспрессией FSHR эмбриональной почки человека (HEK) и вирусно-трансдуцированной гранулезной клеткой человека (KGN) продемонстрировали, что внутриклеточное повышение Ca 2+ может происходить через молекулярный механизм, зависящий от взаимодействия между APPL- 1 и FSHR, а также с участием инозитол-1,4,5-трифосфата (IP 3 ) (25). Интересно, что продукция IP 3 подавляет экспрессию фермента ароматазы, по крайней мере, при чрезмерной экспрессии FSHR (86), что предполагает ингибирующую роль сигнального модуля APPL-1 / IP 3 / Ca 2+ в отношении пола. стероидный синтез.Хотя необходимы дальнейшие исследования для подтверждения этих результатов при наличии физиологических уровней экспрессии FSHR, эти данные показывают, что APPL-1-опосредованная передача сигналов Ca 2+ не обязательно зависит от цАМФ, как было продемонстрировано ранее (87). Более того, человеческая ПКС принадлежит к суперсемейству из примерно 15 изоферментов, активируемых при опосредованной Gq продукции диацилглицерина (DAG) и / или Ca 2+ фосфолипазами на внутриклеточном уровне (88). В яичнике мышей экспрессия изоформ PKC является динамичной и изменяется в зависимости от стадии развития, от пре-полового созревания до взрослого возраста, что позволяет предположить, что различные изоферменты могут контролировать определенные функции яичников, такие как созревание фолликулов, овуляция и лютеинизация (89).
Известно, что PKC противодействует PKA-опосредованному стероидогенезу посредством ингибирования цАМФ в гранулезе (90, 91), и эта функция была дополнительно подтверждена на моделях млекопитающих (92) и птиц (93). Более того, PKC ослабляет белок-зависимую передачу сигналов G α s (94, 95), а также синтез протеогликана в клетках Сертоли (96). Интересно, что несколько сообщений продемонстрировали повышающую регулирующую роль PKC в стероидогенезе клеток Лейдига (97). Действительно, фермент участвует в позитивной модуляции активации цАМФ, pCREB и StAR, увеличивая скорость синтеза стероидов в мышиной линии клеток Leydig MA-10 (98, 99) и в первичных клетках Лейдига мыши (100).В этом случае активация PKC не будет зависеть от FSH из-за отсутствия экспрессии FSHR в клетках Лейдига. Напротив, повышающая регуляция PKC в тека-клетках яичников может быть LH-зависимой и отрицательно влиять на синтез андростендиона in vitro (101), что свидетельствует о существовании полоспецифической функции киназы в регулировании синтеза половых стероидов. в андрогенных клетках.
Антиапоптотический путь pAKT
СвязываниеФСГ с его рецептором опосредует активацию PI3K, ферментов, участвующих в регуляции выживания, роста и дифференцировки клеток (102).В клетках Сертоли ФСГ увеличивает синтез фосфатазы и гомолога тензина, удаленного в хромосоме 10 (PTEN), в течение нескольких минут, независимо от транскрипции мРНК (79), но скорее опосредовано ФСГ-опосредованной дестабилизацией нескольких анти-PTEN miRNA (103). Стабилизация PTEN у зрелых крыс противодействует активности PI3K, когда пролиферация клеток прекращается до наступления половой зрелости. Активация AKT через PI3K может происходить как через PKA-зависимые (104), так и независимые механизмы (63), что отражает роль этой киназы в модуляции пролиферативных и антиапоптотических сигналов в стероидогенных клетках.Действительно, в клетках гранулезы было продемонстрировано взаимодействие между AKT- и cAMP / PKA-путями, регулирующими стероидогенез (105). Более того, также была описана ФСГ-зависимая активация AKT / мишени рапамицина у млекопитающих (mTOR) сигнального модуля (106), положительного регулятора прогрессии клеточного цикла и пролиферации (107) (108–110). Фосфорилирование AKT наблюдалось в клетках гранулезы мышей, где киназа индуцирует инактивацию FOXO1 и экспрессию циклина D2, что приводит к пролиферации и дифференцировке клеток в ответ на ФСГ (111).Фактически, недавние полногеномные исследования показали, что большинство чувствительных к ФСГ генов в клетках гранулезы являются генами-мишенями FOXO (33). Новое понимание ФСГ-опосредованной защиты от атрезии стало возможным благодаря открытию того, что ядерное исключение (ингибирование) FOXO при активации сигнального пути PIK3 / AKT / mTOR предотвращает аутофагию гранулезных клеток (112, 113). Актуальность активации pAKT для репродукции была подчеркнута в экспериментах in vitro , в которых преантральные фолликулярные гранулезные клетки мышей культивировали совместно с ооцитами (114).Присутствие клеток гранулезы подавляло апоптоз ооцитов посредством PI3K / AKT, способствуя росту гамет. В частности, было описано, что AKT регулирует возобновление мейоза в нескольких моделях животных (115–117). Наконец, путь AKT является предпочтительной мишенью для ЛГ (118), и его активация даже усиливается в присутствии ФСГ (119, 120), предполагая, что антиапоптотические и пролиферативные стимулы потребуются во время поздней антральной фолликулярной фазы для подготовки поздние стадии созревания ооцитов и достижение овуляции.Взятые вместе, путь PI3K / AKT может действовать согласованно с mTOR (108), регулирующим сигнал выживания в яичнике. Эти сигналы являются основополагающими для выживания фолликулов от первичных до граафовых, а также для созревания и роста ооцитов. В этом контексте разумно, что антиапоптотическая активность PI3K / AKT, опосредованная FSHR, является фундаментальной для противодействия проапототическим стимулам цАМФ / PKA и спасения фолликула от атрезии (121). Фактически, нарушение регуляции этого сигнального каскада может нарушать женский гаметогенез, и это было описано как причина бесплодия (122).Интересные данные, объясняющие, как уравновешиваются сигналы, доставляемые по путям цАМФ / PKA и PI3K / AKT, получены из анализа обработки клеток Сертоли ФСГ. В этой модели ФСГ имеет двойное, стадийно-зависимое действие. Хотя гормон стимулирует пролиферацию незрелых клеток за счет активации путей PI3K / AKT-, mTOR- и ERK1 / 2, он предпочтительно стимулирует выработку цАМФ в зрелых клетках Сертоли, что приводит к ингибированию PI3K / AKT и остановке пролиферации клеток (110, 123). Хотя этот эффект может быть связан с изменением компетентности клеток Сертоли, когда активация пути PI3K / AKT становится зависимой от паракринных факторов на поздних стадиях созревания (124), он представляет собой пример двойной регуляции сигналов жизни и смерти. пользователя FSH.
Выводы
FSH опосредует множественные сигнальные пути, связываясь со своим уникальным GPCR (125). На внутриклеточном уровне ФСГ способен стимулировать рост и выживание клеток в отличие от стероидогенных сигналов, перекрестно связанных с апоптозом, что приводит к тонкой регуляции гаметогенеза и, в целом, репродукции. В мужских половых железах ФСГ индуцирует пролиферацию клеток Сертоли через AKT- и ERK1 / 2-пути, и роль этих сигнальных каскадов, которые являются пролиферативными и антиапоптотическими, отражается во время фолликулогенеза, созревания ооцитов и роста в яичник.Синтез стероидных гормонов, в основном опосредованный активацией пути цАМФ / PKA, является первичной конечной точкой функционирования ФСГ в клетках гранулезы во время антральной стадии фолликулогенеза. Эстрогены — это конечные продукты, необходимые для правильного развития доминантного фолликула за счет скарификации других, которые становятся атретическими . Хорошо известно, что фолликулярная атрезия возникает из-за снижения поддержки ФСГ. Однако данные in vitro подтверждают неожиданные, специфичные для стадии проапоптотические сигналы, доставляемые гормоном, который может играть роль in vivo , и этот вопрос заслуживает дальнейшего изучения.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарны Министерству университетов и исследований Италии за поддержку Департамента биомедицинских, метаболических и нейронных наук (Университет Модены и Реджо-Эмилия, Италия) в контексте программы Департамента повышения квалификации.Мы также в долгу перед отделом PHASE Национального института исследований в области агрономии, Национальным исследовательским центром Франции, Национальным исследовательским агентством Франции в рамках программы Соглашения о гранте на инвестиции LabEx MabImprove: ANR-10-LABX-53, и на гранты GPCRAb (ARD2020 BIOMEDICAMENTS, контракт № 32000593) от Région Center.
Список литературы
4. Симони М., Громолл Дж., Нишлаг Э. Рецептор фолликулостимулирующего гормона: биохимия, молекулярная биология, физиология и патофизиология. Endocr Rev. (1997) 18: 739–73. DOI: 10.1210 / edrv.18.6.0320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Цзян Х, Фишер Д., Чен Х, МакКенна С.Д., Лю Х., Шрираман В. и др. Доказательства рецептора фолликулостимулирующего гормона как функционального тримера. J. Biol Chem. (2014) 289: 14273–82. DOI: 10.1074 / jbc.M114.549592
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Цзян X, Лю Х., Чен Х, Чен П.Х., Фишер Д., Шрираман В. и др.Структура фолликулостимулирующего гормона в комплексе со всем эктодоменом его рецептора. Proc Natl Acad Sci. (2012) 109: 12491–6. DOI: 10.1073 / pnas.1206643109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Gloaguen P, Crépieux P, Heitzler D, Poupon A, Reiter E. Картирование сигнальных сетей, индуцированных фолликулостимулирующим гормоном. Передний эндокринол. (2011) 2:45. DOI: 10.3389 / fendo.2011.00045
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8.Йонас К.С., Риверо-Мюллер А., Хухтаниеми ИТ, Ханьялоглу А.С. Трансактивация рецепторов, связанных с G-белками. Methods Cell Biol. (2013) 117: 433–50. DOI: 10.1016 / B978-0-12-408143-7.00023-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Риверо-Мюллер А., Чжоу И-Й, Джи И., Ладжич С., Ханиалоглу А.С., Йонас К. и др. Восстановление дефектной функции рецептора, сопряженного с G-белком, in vivo за счет межмолекулярного взаимодействия. Proc Natl Acad Sci. (2010) 107: 2319–24.DOI: 10.1073 / pnas.0
5106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Фэн Х, Чжан М., Гуань Р., Сегалофф Д.Л. Гетеродимеризация между рецепторами лутропина и фоллитропина связана с ослаблением гормон-зависимой передачи сигналов. Эндокринология. (2013) 154: 3925–30. DOI: 10.1210 / en.2013-1407
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Казарини Л., Санти Д., Симони М., Поти Ф. «Запасные» рецепторы лютеинизирующего гормона: факты и вымысел. Trends Endocrinol Metabol. (2018) 29: 208–17. DOI: 10.1016 / j.tem.2018.01.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Йонас К.С., Чен С., Вирта М., Мора Дж., Франкс С., Хухтаниеми И. и др. Временное перепрограммирование передачи сигналов кальция через перекрестные помехи рецепторов гонадотропина, которые ассоциируются как функционально асимметричные гетеромеры. Научный доклад (2018) 8: 2239. DOI: 10.1038 / s41598-018-20722-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14.Baumgarten SC, Convissar SM, Fierro MA, Winston NJ, Scoccia B, Stocco C. Передача сигналов IGF1R необходима для вызванной ФСГ активации AKT и дифференцировки клеток гранулезного кумулюса человека. J Clin Endocrinol Metabol. (2014) 99: 2995–3004. DOI: 10.1210 / jc.2014-1139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Уэйн С.М., Фан Х-И, Ченг X, Ричардс Дж. С.. Фолликулостимулирующий гормон индуцирует множественные сигнальные каскады: доказательства того, что активация онкогена саркомы Рауса, RAS, и рецептора эпидермального фактора роста имеют решающее значение для дифференцировки гранулезных клеток. Mol Endocrinol. (2007) 21: 1940–57. DOI: 10.1210 / me.2007-0020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Rougny A, Gloaguen P, Langonné N, Reiter E, Crépieux P, Poupon A, et al. Основанный на логике метод построения сетей сигнализации и предложения экспериментальных планов. Научный доклад (2018) 8: 7830. DOI: 10.1038 / s41598-018-26006-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Кан Р.А., Гилман АГ. АДФ-рибозилирование Gs способствует диссоциации его альфа- и бета-субъединиц. J. Biol Chem. (1984) 259: 6235–40.
PubMed Аннотация | Google Scholar
18. Де Паскали Ф., Трефье А., Ландомель Ф., Бозон В., Бруно Г., Ивинек Р. и др. «Рецептор фолликулостимулирующего гормона: достижения и нерешенные проблемы». Int Rev Cell Mol Biol. (2018) 338: 1–58. DOI: 10.1016 / bs.ircmb.2018.02.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Федерман А.Д., Конклин Б.Р., Шредер К.А., Рид Р.Р., Борн Х.Р. Гормональная стимуляция аденилатциклазы через субъединицы бета-гамма Gi-протеина. Природа . (1992) 356: 159–61. DOI: 10.1038 / 356159a0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Koch WJ, Hawes BE, Inglese J, Luttrell LM, Lefkowitz RJ. Клеточная экспрессия карбоксильного конца киназы рецептора, связанного с G-белком, ослабляет G-бета-гамма-опосредованную передачу сигналов. J. Biol Chem. (1994) 269: 6193–7.
PubMed Аннотация | Google Scholar
21. Troispoux C, Guillou F, Elalouf JM, Firsov D, Iacovelli L, De Blasi A, et al.Участие G-протеин-связанных рецепторных киназ и аррестинов в десенсибилизации к действию фолликулостимулирующего гормона. Mol Endocrinol. (1999) 13: 1599–614. DOI: 10.1210 / исправление.13.9.0342
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Кришнамурти Х., Галет С., Асколи М. Ассоциация аррестина-3 с рецептором фоллитропина зависит от активации рецептора и фосфорилирования. Mol Cell Endocrinol. (2003) 204: 127–40. DOI: 10.1016 / S0303-7207 (03) 00088-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23.Crépieux P, Poupon A, Langonné-Gallay N, Reiter E, Delgado J, Schaefer MH и др. Исчерпывающий обзор β-аррестинома. Передний эндокринол. (2017) 8:32. DOI: 10.3389 / fendo.2017.00032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Де Паскали Ф., Рейтер Э. β-аррестины и смещенная передача сигналов в рецепторах гонадотропина. Майнер Гинеколь. (2018) 70: 525–38. DOI: 10.23736 / S0026-4784.18.04272-7
CrossRef Полный текст | Google Scholar
25.Thomas RM, Nechamen CA, Mazurkiewicz JE, Ulloa-Aguirre A, Dias JA. Адаптерный белок APPL1 связывает рецептор ФСГ с продукцией инозитол-1,4,5-трифосфата и участвует во внутриклеточной мобилизации Ca 2+ . Эндокринология. (2011) 152: 1691–701. DOI: 10.1210 / en.2010-1353
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Nechamen CA, Thomas RM, Cohen BD, Acevedo G, Poulikakos PI, Testa JR, et al. Рецептор человеческого фолликулостимулирующего гормона (ФСГ) взаимодействует с адаптерным белком APPL1 в клетках HEK 293: потенциальное участие пути PI3K в передаче сигналов ФСГ. Biol Reproduc. (2004) 71: 629–36. DOI: 10.1095 / биолрепрод.103.025833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Спосини С., Жан-Альфонс Ф.Г., Аюб М.А., Оква А., Вест К., Лавери С. и др. Интеграция передачи сигналов GPCR и сортировки из очень ранних эндосом через противоположные механизмы APPL1. Cell Rep. (2017) 21: 2855–67. DOI: 10.1016 / j.celrep.2017.11.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28.Жан-Альфонс Ф., Бауэрсокс С., Чен С., Борода Дж., Путхенведу М.А., Ханиалоглу А.С. Пространственно ограниченная активность рецептора, связанного с G-белком, через дивергентные эндоцитарные компартменты. J. Biol Chem. (2014) 289: 3960–77. DOI: 10.1074 / jbc.M113.526350
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Cohen BD, Nechamen CA, Dias JA. Рецептор фоллитропина человека (FSHR) взаимодействует с адаптерным белком 14-3-3τ. Mol Cell Endocrinol. (2004) 220: 1–7. DOI: 10.1016 / j.mce.2004.04.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Dias JA, Mahale SD, Nechamen CA, Davydenko O, Thomas RM, Ulloa-Aguirre A. Новые роли адапторного белка рецептора FSH APPL1 и перекрытие предполагаемого домена взаимодействия 14-3-3τ с каноническим G-белком сайт взаимодействия. Mol Cell Endocrinol. (2010) 329: 17–25. DOI: 10.1016 / j.mce.2010.05.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31.Фридманн С., Сарит Ф., Дантес А., Ада Д., Амстердам А., Абрахам А. Транскриптомы яичников как инструмент глобального подхода к генам, модулируемым гонадотропными гормонами в клетках гранулезы яичников человека. Эндокринная. (2005) 26: 259–65. DOI: 10.1385 / ENDO: 26: 3: 259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Perlman S, Bouquin T, van den Hazel B, Jensen TH, Schambye HT, Knudsen S, et al. Транскриптомный анализ стимуляции ФСГ и вариантов ФСГ в клетках гранулезы от пациентов с IVM выявляет новые регулируемые гены. MHR Basic Sci Reproduc Med. (2006) 12: 135–44. DOI: 10,1093 / мольхр / gah347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Herndon MK, Law NC, Donaubauer EM, Kyriss B, Hunzicker-Dunn M. Forkhead box O-член FOXO1 регулирует большинство чувствительных к фолликулостимулирующему гормону генов в клетках гранулезы яичников. Mol Cell Endocrinol. (2016) 434: 116–26. DOI: 10.1016 / j.mce.2016.06.020
CrossRef Полный текст | Google Scholar
34.Завод ТМ, Маршалл ГР. Функциональное значение ФСГ в сперматогенезе и контроле его секреции у самцов приматов. Endocr Rev. (2001) 22: 764–86. DOI: 10.1210 / edrv.22.6.0446
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Амстердам А., Сассон Р., Керен-Тал И., Ахарони Д., Дантес А., Римон Е. и др. Альтернативные пути апоптоза яичников: смерть на всю жизнь. Biochem Pharmacol. (2003) 66: 1355–62. DOI: 10.1016 / S0006-2952 (03) 00485-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38.Casarini L, Reiter E, Simoni M. β-аррестины регулируют пролиферацию клеток, опосредованную рецептором гонадотропина, и апоптоз, контролируя различную внутриклеточную передачу сигналов FSHR или LHCGR в линии клеток hGL5. Mol Cell Endocrinol. (2016) 437: 11–21. DOI: 10.1016 / j.mce.2016.08.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Gilman AG. Анализ связывания с белками аденозин-3 ‘: 5’-циклического монофосфата. Proc Natl Acad Sci USA. (1970) 67: 305–12.
PubMed Аннотация | Google Scholar
40. Конти М., Андерсен С.Б., Ричард Ф., Мехатс С., Чун С.Ю., Хорнер К. и др. Роль передачи сигналов циклических нуклеотидов в созревании ооцитов. Mol Cell Endocrinol. (2002) 187: 153–9. DOI: 10.1016 / S0303-7207 (01) 00686-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Sposini S, Hanyaloglu AC. Эволюция взглядов на мембранный трафик и сигнальные системы для рецепторов, связанных с G-белком. Prog Mol Subcell Biol. (2018) 57: 273–99. DOI: 10.1007 / 978-3-319-96704-2_10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Джонстон ТБ, Агарвал С.Р., Харви Р.Д., Остром Р.С. Компартментация передачи сигналов цАМФ: аденилатциклазы как якоря динамических сигнальных комплексов. Mol Pharmacol. (2018) 93: 270–6. DOI: 10.1124 / mol.117.110825
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Conti M, Kasson BG, Hsueh AJ. Гормональная регуляция 3 ‘, 5’-аденозинмонофосфат фосфодиэстераз в культивируемых клетках гранулезы крысы. Эндокринология. (1984) 114: 2361–8. DOI: 10.1210 / эндо-114-6-2361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Трефье А., Мюзнье А., Ландомель Ф., Буркар Т., Було Т., Аюб М.А. и др. G-белок-зависимая передача сигналов запускает β-аррестин-каркасный модуль p70S6K / rpS6, который контролирует трансляцию 5’TOP мРНК. FASEB J. (2018) 32: 1154–69. DOI: 10.1096 / fj.201700763R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45.Карр Д.В., Деманно Д.А., Этвуд А., Ханзикер-Данн М., Скотт Д.Д. Фолликулостимулирующая гормональная регуляция белков, закрепляющих А-киназу в клетках гранулезы. J. Biol Chem. (1993) 268: 20729–32.
PubMed Аннотация | Google Scholar
46. Ориентир Б.Ф., Фауске Б., Эскильд В., Скалхегг Б., Ломанн С.М., Ханссон В. и др. Идентификация, характеристика и гормональная регуляция 3 ‘, 5’-циклических аденозинмонофосфат-зависимых протеинкиназ в клетках Сертоли крыс *. Эндокринология. (1991) 129: 2345–54. DOI: 10.1210 / эндо-129-5-2345
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Crépieux P, Marion S, Martinat N, Fafeur V, Vern YL, Kerboeuf D, et al. ERK-зависимая передача сигналов специфично модулируется ФСГ во время первичного созревания клеток Сертоли. Онкоген. (2001) 20: 4696–709. DOI: 10.1038 / sj.onc.1204632
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Коттом Дж., Сальвадор Л. М., Майзелс Е. Т., Рейерстад С., Парк И., Карр Д. В. и др.Фолликулостимулирующий гормон активирует киназу, регулируемую внеклеточным сигналом, но не киназу, регулируемую внеклеточным сигналом, через фосфотирозинфосфатазу 100 кДа. J. Biol Chem. (2003) 278: 7167–79. DOI: 10.1074 / jbc.M203
0
CrossRef Полный текст | Google Scholar
49. Law NC, Donaubauer EM, Zeleznik AJ, Hunzicker-Dunn M. Как протеинкиназа A активирует канонические сигнальные пути тирозинкиназы, чтобы способствовать дифференцировке гранулезных клеток. Эндокринология. (2017) 158: 2043–51. DOI: 10.1210 / en.2017-00163
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Кара Э., Крепье П., Готье С., Мартина Н., Пикетти В., Гийу Ф. и др. Кластер фосфорилирования из пяти остатков серина и треонина на С-конце рецептора фолликулостимулирующего гормона важен для десенсибилизации, но не для опосредованной бета-аррестином активации ERK. Mol Endocrinol. (2006) 20: 3014–26. DOI: 10.1210 / me.2006-0098
CrossRef Полный текст | Google Scholar
51.Казарини Л., Мориондо В., Марино М., Адверси Ф., Каподанно Ф., Гризолия С. и др. Полиморфизм FSHR p.N680S опосредует различные ответы на FSH in vitro. Mol Cell Endocrinol. (2014) 393: 83–91. DOI: 10.1016 / j.mce.2014.06.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Manna PR, Chandrala SP, Jo Y, Stocco DM. ЦАМФ-независимая передача сигналов регулирует стероидогенез в клетках Лейдига мыши в отсутствие фосфорилирования StAR. J Mol Endocrinol. (2006) 37: 81–95. DOI: 10.1677 / jme.1.02065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Мур Р.К., Оцука Ф., Шимасаки С. Роль ERK1 / 2 в дифференциальном синтезе прогестерона и эстрадиола клетками гранулезы. Biochem Biophys Res Commun. (2001) 289: 796–800. DOI: 10.1006 / bbrc.2001.6052
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Таджима К., Йошии К., Фукуда С., Орисака М., Миямото К., Амстердам А. и др.Индуцированная лютеинизирующим гормоном активация киназы, регулируемая внеклеточными сигналами, по-разному модулирует выработку прогестерона и андростендиона в тека-клетках крупного рогатого скота. Эндокринология. (2005) 146: 2903–10. DOI: 10.1210 / en.2005-0093
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Амстердам А., Ханох Т., Дантес А., Таджима К., Штраус Дж. Ф., Сегер Р. Механизмы десенсибилизации гонадотропинами. Mol Cell Endocrinol. (2002) 187: 69–74. DOI: 10.1016 / S0303-7207 (01) 00701-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57.Питер А.Т., Дханасекаран Н. Апоптоз гранулезных клеток: обзор роли MAPK-сигнальных модулей. Reproduc Domestic Anim. (2003) 38: 209–13. DOI: 10.1046 / j.1439-0531.2003.00438.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Сальвадор Л.М., Парк Й., Коттом Дж., Майзелс Е.Т., Джонс Дж. К., Шиллаче Р. В. и др. Фолликулостимулирующий гормон стимулирует опосредованное протеинкиназой А фосфорилирование и ацетилирование гистона h4, что приводит к селективной активации гена в клетках гранулезы яичника. J. Biol Chem. (2001) 276: 40146–55. DOI: 10.1074 / jbc.M106710200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Деманно Д.А., Коттом Дж.Э., Клайн М.П., Питерс К.А., Майзелс Е.Т., Ханзикер-Данн М. Фолликулостимулирующий гормон способствует фосфорилированию гистона h4 по серину-10. Mol Endocrinol. (1999) 13: 91–105. DOI: 10.1210 / исправление.13.1.0222
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Пури П., Литтл-Ириг Л., Чандран Ю., Ло, Северная Каролина, Хунзикер-Данн М., Железник А.Дж.Протеинкиназа А: основная киназа дифференцировки гранулезных клеток. Научный доклад (2016) 6: 28132. DOI: 10.1038 / srep28132
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Schmidt M, Dekker FJ, Maarsingh H. Обменный белок, непосредственно активируемый цАМФ (epac): многодоменный медиатор цАМФ в регуляции различных биологических функций. Pharmacol Rev. (2013) 65: 670–709. DOI: 10.1124 / pr.110.003707
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62.Чой Дж.Х., Чен Си-Л, Пун С.Л., Ван Х-С, Люн ПКК. Экспрессия рецептора эпидермального фактора роста, стимулированная гонадотропином, в поверхностных эпителиальных клетках яичников человека: участие циклического АМФ-зависимого обменного белка, активируемого путем цАМФ. Endocr Relat Cancer. (2009) 16: 179–88. DOI: 10.1677 / ERC-07-0238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Meroni SB, Riera MF, Pellizzari EH, Cigorraga SB. Регулирование функции клеток Сертоли крысы с помощью ФСГ: возможная роль пути фосфатидилинозитол-3-киназы / протеинкиназы B. J Endocrinol. (2002) 174: 195–204. DOI: 10.1677 / joe.0.1740195
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Амстердам А., Голд Р.С., Хосокава К., Йошида Ю., Сассон Р., Юнг И. и др. Перекрестные помехи между множественными сигнальными путями, контролирующими гибель клеток яичников. Trends Endocrinol Metabol. (1999) 10: 255–62. DOI: 10.1016 / S1043-2760 (99) 00164-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Ума Дж., Мурали П., Верма-Кумар С., Медхамурти Р.Определение начала апоптоза в гранулезных клетках преовуляторных фолликулов шляпной обезьяны ( Macaca radiata ): корреляция с активностью митоген-активированной протеинкиназы. Biol Reproduc. (2003) 69: 1379–87. DOI: 10.1095 / биолрепрод.103.017897
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Сиота М., Сугай Н., Тамура М., Ямагути Р., Фукусима Н., Мияно Т. и др. Корреляция активности митоген-активированной протеинкиназы с выживаемостью клеток и апоптозом в клетках гранулезы свиней. Zool Sci. (2003) 20: 193–201. DOI: 10.2108 / zsj.20.193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Гебауэр Г., Питер А.Т., Онесим Д., Дханасекаран Н. Апоптоз гранулезных клеток яичника: корреляция со сниженной активностью модуля передачи сигналов ERK. J. Cell Biochem. (1999) 75: 547–54. DOI: 10.1002 / (SICI) 1097-4644 (199
) 75: 43.3.CO; 2-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. Шиффер З., Керен-Тал И., Дойч М., Дантес А., Ахарони Д., Вайнерб А. и др.Фурье-анализ дифференциального светорассеяния для количественного определения ФСГ-ответа, связанного со структурными изменениями в иммортализованных клетках гранулезы. Mol Cell Endocrinol. (1996) 118: 145–53. DOI: 10.1016 / 0303-7207 (96) 03774-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
70. Амстердам А., Дантес А., Лискович М. Роль фосфолипазы-D и фосфатидной кислоты в опосредовании индуцированного гонадотропин-рилизинг-гормоном ингибирования дифференцировки преантральных гранулезных клеток. Эндокринология. (1994) 135: 1205–11. DOI: 10.1210 / endo.135.3.8070364
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Maizels ET, Cottom J, Jones JC, Hunzicker-Dunn M. Фолликулостимулирующий гормон (ФСГ) активирует путь митоген-активируемой протеинкиназы p38, вызывая фосфорилирование небольшого белка теплового шока и округление клеток в незрелых клетках гранулезы яичника крыс. Эндокринология. (1998) 139: 3353–6. DOI: 10.1210 / endo.139.7.6188
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72.Di Giacomo M, Camaioni A, Klinger FG, Bonfiglio R, Salustri A. Циклические AMP-повышающие агенты способствуют выживанию кумулюсных клеток и стабильности гиалуроновой матрицы, тем самым продлевая время оплодотворения ооцитов мыши. J. Biol Chem. (2016) 291: 3821–36. DOI: 10.1074 / jbc.M115.680983
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Ю Ф-Кью, Хань Ц.-С, Ян В., Цзинь Х, Ху З-И, Лю И-Х. Активация пути p38 MAPK фолликулостимулирующим гормоном дифференцированно регулирует стероидогенез в клетках гранулезы. J Endocrinol. (2005) 186: 85–96. DOI: 10.1677 / joe.1.05955
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74. Инагаки К., Оцука Ф., Миёси Т., Ямасита М., Такахаши М., Гото Дж. И др. p38-митоген-активированная протеинкиназа стимулировала стероидогенез в сокультурах гранулезных клеток и ооцитов: роль костных морфогенетических белков 2 и 4. Эндокринология. (2009) 150: 1921–30. DOI: 10.1210 / en.2008-0851
PubMed Аннотация | CrossRef Полный текст | Google Scholar
75.Ли Дж., Чжоу К., Ма З., Ван М., Шен В. Дж., Азхар С. и др. Подавление обратной связи передачи сигналов CREB с помощью p38 MAPK способствует отрицательной регуляции стероидогенеза. Reproduc Biol Endocrinol. (2017) 15:19. DOI: 10.1186 / s12958-017-0239-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Транчант Т., Дюран Дж., Готье С., Крепье П., Ульоа-Агирр А., Ройер Д. и др. Предпочтительная передача сигналов β-аррестина при низкой плотности рецепторов, выявленная функциональной характеристикой мутации V рецептора A189 человека ФСГ. Mol Cell Endocrinol. (2011) 331: 109–18. DOI: 10.1016 / j.mce.2010.08.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Сассон Р., Дантес А., Таджима К., Амстердам А. Новые гены, модулируемые ФСГ в нормальных и иммортализованных ФСГ-чувствительных клетках: новое понимание механизма действия ФСГ. FASEB J. (2003) 17: 1256–66. DOI: 10.1096 / fj.02-0740com
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Jeppesen JV, Кристенсен С.Г., Нильсен М.Э., Хумайдан П., Даль Канто М., Фадини Р. и др.Экспрессия гена LH-рецептора в клетках гранулезы и кумулюса человека антральных и преовуляторных фолликулов. J Clin Endocrinol Metabol. (2012) 97: E1524–31. DOI: 10.1210 / jc.2012-1427
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Dupont J, Musnier A., Decourtye J, Boulo T, Lécureuil C, Guillou H, et al. Активность PTEN, стимулированная ФСГ, объясняет отсутствие митогенного эффекта ФСГ в клетках Сертоли препубертатных крыс. Mol Cell Endocrinol. (2010) 315: 271–6.DOI: 10.1016 / j.mce.2009.09.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
80. Ямасита Ю., Окамото М., Икеда М., Окамото А., Сакаи М., Гунджи Ю. и др. Протеинкиназа C (PKC) увеличивает активность фермента TACE / ADAM17 в соматических клетках яичников свиней, что важно для лютеинизации гранулезных клеток и созревания ооцитов. Эндокринология. (2014) 155: 1080–90. DOI: 10.1210 / en.2013-1655
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81.Горчинска Э., Спаливьеро Дж., Хандельсман Д. Взаимосвязь между 3 ‘, 5’-циклическим аденозинмонофосфатом и кальцием в опосредовании передачи сигнала фолликулостимулирующего гормона в клетках Сертоли. Эндокринология. (1994) 134: 293–300. DOI: 10.1210 / endo.134.1.8275946
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Meroni S, Cánepa D, Pellizzari E, Schteingart H, Cigorraga S. Регулирование активности гамма-глутамилтранспептидазы с помощью Са (2 +) — и протеинкиназы C-зависимых путей в клетках Сертоли. Int J Androl. (1997) 20: 189–94. DOI: 10.1046 / j.1365-2605.1997.00053.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Флорес Дж. А., Вельдхейс Дж. Д., Леонг Д. А.. Фолликулостимулирующий гормон вызывает повышение внутриклеточной концентрации свободных ионов кальция в отдельных клетках яичников (гранулезных). Эндокринология. (1990) 127: 3172–9. DOI: 10.1210 / эндо-127-6-3172
PubMed Аннотация | CrossRef Полный текст | Google Scholar
84.Потеря Э.С., Якобус А.П., Вассерманн Г.Ф. Быстрые сигнальные реакции в мембранах клеток Сертоли, вызванные фолликулостимулирующим гормоном и тестостероном: приток кальция и электрофизиологические изменения. Life Sci. (2011) 89: 577–83. DOI: 10.1016 / j.lfs.2011.05.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Линь И-Ф, Цзэн М-Дж, Сюй Х-Л, Ву И-В, Ли И-Х, Цай И-Х. Новый индуцированный фолликулостимулирующим гормоном сигнальный путь G альфа h / фосфолипазы C-delta1, опосредующий Ca2 + -приток клеток Сертоли. Mol Endocrinol. (2006) 20: 2514–27. DOI: 10.1210 / me.2005-0347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
86. Donadeu FX, Ascoli M. Дифференциальные эффекты рецепторов гонадотропина на экспрессию ароматазы в первичных культурах незрелых клеток гранулезы крысы сильно зависят от плотности экспрессируемых рецепторов и активации инозитолфосфатного каскада. Эндокринология. (2005) 146: 3907–16. DOI: 10.1210 / en.2005-0403
PubMed Аннотация | CrossRef Полный текст | Google Scholar
87.Флорес Дж. А., Леонг Д. А., Вельдхейс Дж. Д.. Опосредован ли кальциевый сигнал фолликулостимулирующим гормоном в клетках гранулезы свиней аденозинциклической 3 ‘, 5’-монофосфат-зависимой протеинкиназой? Эндокринология. (1992) 130: 1862–6. DOI: 10.1210 / endo.130.4.1547716
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Тепекой Ф., Устунел И., Аккоюнлу Г. Изоформы протеинкиназы С α, δ и ε по-разному экспрессируются в яичниках мышей на разных стадиях постнатального развития. J Ovarian Res. (2014) 7: 117. DOI: 10.1186 / s13048-014-0117-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90. Manna PR, Pakarainen P, Rannikko AS, Huhtaniemi IT. Механизмы десенсибилизации действия фолликулостимулирующего гормона (ФСГ) в линии клеток мышиной гранулезы, стабильно трансфицированной комплементарной дезоксирибонуклеиновой кислотой рецептора ФСГ человека. Mol Cell Endocrinol. (1998) 146: 163–76. DOI: 10.1016 / S0303-7207 (98) 00156-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91.Гонсалес Рейес Дж., Сантана П., Гонсалес Робайна И., Кабрера Олива Дж., Эстевес Ф., Эрнандес И. и др. Влияние ингибитора протеинфосфатазы окадаиновой кислоты на ФСГ-индуцированный стероидогенез гранулезных клеток. J Endocrinol. (1997) 152: 131–9. DOI: 10.1677 / joe.0.1520131
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Немер А., Азаб А. Н., Римон Г., Лампрехт С., Бен-Менахем Д. Различные роли передачи сигналов цАМФ / PKA и PKC в регулировании уровней прогестерона и PGE2 в иммортализованных культурах клеток гранулезы крысы. Gen Comp Endocrinol. (2018) 269: 88–95. DOI: 10.1016 / j.ygcen.2018.08.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93. Джамалуддин М., Мольнар М., Маррон Б.Л., Хертеленди Ф. Трансдукция сигнала в клетках гранулезы птиц: эффекты ингибиторов протеинкиназы С. Gen Comp Endocrinol. (1994) 93: 471–9. DOI: 10.1006 / gcen.1994.1051
PubMed Аннотация | CrossRef Полный текст | Google Scholar
94. Эскола В., Риханен П., Сависало М., Ранникко А., Кананен К., Шпренгель Р. и др.Стабильная трансфекция комплементарной ДНК рецептора фолликулостимулирующего гормона крысы в иммортализованную линию клеток Сертоли мыши. Mol Cell Endocrinol. (1998) 139: 143–52. DOI: 10.1016 / S0303-7207 (98) 00063-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Эйквар Л., Таскен К.А., Эскилд В., Ханссон В. Активация протеинкиназы С и регуляция уровней 3 ‘, 5’-циклического аденозинмонофосфата в культивируемых клетках Сертоли крыс с помощью позитивных и негативных агонистов. Acta Endocrinol. (1993) 128: 568–72. DOI: 10.1530 / acta.0.1280568
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Fagnen G, Phamantu NT, Bocquet J, Bonnamy PJ. Активация протеинкиназы С увеличивает синтез протеогликана в незрелых клетках Сертоли крысы. Biochim Biophys Acta. (1999) 1472: 250–61. DOI: 10.1016 / S0304-4165 (99) 00128-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
97. Кук Б.А., Чой М.С., Дирами Дж., Лопес-Руис М.П., Вест А.П.Контроль стероидогенеза в клетках Лейдига. J Стероид Biochem Mol Biol. (1992) 43: 445–9. DOI: 10.1016 / 0960-0760 (92) -U
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Manna PR, Soh JW, Stocco DM. Участие специфических изоферментов PKC в опосредованной сложным форболовым эфиром регуляции стероидогенной острой регуляторной экспрессии белков и синтеза стероидов в клетках лейдига мышей. Эндокринология. (2011) 152: 313–25. DOI: 10.1210 / en.2010-0874
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99.Manna PR, Huhtaniemi IT, Stocco DM. Механизмы передачи сигналов протеинкиназы С в модуляции 3 ‘, 5’-циклического аденозинмонофосфат-опосредованного стероидогенеза в клетках гонад мышей. Эндокринология. (2009) 150: 3308–17. DOI: 10.1210 / en.2008-1668
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Costa RR, Reis RI dos, Aguiar JF, Varanda WA. Лютеинизирующий гормон (ЛГ) действует через PKA и PKC, модулируя кальциевые токи Т-типа и переходные процессы внутриклеточного кальция в клетках Лейдига мышей. Cell Calcium. (2011) 49: 191–9. DOI: 10.1016 / j.ceca.2011.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101. Захов Р.Дж., Терранова П.Ф. Участие путей протеинкиназы С и протеинтирозинкиназы в индуцированном фактором некроза опухоли альфа кластеризации интерстициальных клеток теки яичника. Mol Cell Endocrinol. (1993) 97: 37–49. DOI: 10.1016 / 0303-7207 (93)
-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102.Ливерс С.Дж., Ванасебрук Б., Уотерфилд, доктор медицины. Передача сигналов через фосфоинозитид-3-киназы: липиды занимают центральное место. Curr Opin Cell Biol. (1999) 11: 219–25. DOI: 10.1016 / S0955-0674 (99) 80029-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Николлс П.К., Харрисон Калифорния, Уолтон К.Л., Маклахлан Р.И., О’Доннелл Л., Стэнтон П.Г. Гормональная регуляция микро-РНК клеток Сертоли при спермии. Эндокринология. (2011) 152: 1670–83. DOI: 10.1210 / en.2010-1341
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Hunzicker-Dunn ME, Lopez-Biladeau B, Law NC, Fiedler SE, Carr DW, Maizels ET. PKA и GAB2 играют центральную роль в пути передачи сигналов FSH к PI3K и AKT в клетках гранулезы яичников. Proc Natl Acad Sci. (2012) 109: E2979–88. DOI: 10.1073 / pnas.1205661109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
105. Чен И-Дж., Сяо П-В, Ли М-Т, Мейсон Джи, Ке Ф-К, Хван Дж-Дж.Взаимодействие передачи сигналов PI3K и цАМФ / PKA и гиперчувствительность к рапамицину в усилении TGFbeta1 стимулированного ФСГ стероидогенеза в клетках гранулезы яичников крыс. J Endocrinol. (2007) 192: 405–19. DOI: 10.1677 / JOE-06-0076
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Рехниц Дж., Алкоба Д.Д., Брам И.С., Хиндерхофер К., Юнесс Б., Стровицки Т. и др. Пути передачи сигналов FMR1 и AKT / mTOR: потенциальные функциональные взаимодействия, контролирующие фолликулогенез в клетках гранулезы человека. Reproduc BioMed. (2017) 35: 485–93. DOI: 10.1016 / j.rbmo.2017.07.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Кинг Д., Йомансон Д., Брайант Х. PI3King the lock: нацеливание на путь PI3K / Akt / mTOR в качестве новой терапевтической стратегии при нейробластоме. J Pediatr Hematol / Oncol. (2015) 37: 245–51. DOI: 10.1097 / MPH.0000000000000329
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Алам Х., Майзелс Е.Т., Парк Й., Гэй С., Фейгер З.Дж., Чандель Н.С. и др.Активация фолликулостимулирующего гормона индуцируемого гипоксией фактора-1 с помощью гомолога фосфатидилинозитол-3-киназы / AKT / Ras, обогащенного в мозге (Rheb) / пути рапамицина у млекопитающих (mTOR), необходима для индукции выбранных белковых маркеров дифференцировки фолликулов. J. Biol Chem. (2004) 279: 19431–40. DOI: 10.1074 / jbc.M401235200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Лекурей С., Тессеро С., Кара Е., Мартинат Н., Соу А., Фонтен И. и др.Фолликулостимулирующий гормон активирует киназу рибосомного протеина S6 p70 посредством опосредованного протеинкиназой А дефосфорилирования Thr 421 / Ser 424 в первичных клетках Сертоли. Mol Endocrinol. (2005) 19: 1812–20. DOI: 10.1210 / me.2004-0289
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Musnier A, Heitzler D, Boulo T, Tesseraud S, Durand G, Lécureuil C и др. Регуляция развития киназы p70 S6 с помощью рецептора, связанного с G-белком, динамически моделируется в первичных клетках. Cell Mol Life Sci. (2009) 66: 3487–503. DOI: 10.1007 / s00018-009-0134-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Park Y, Maizels ET, Feiger ZJ, Alam H, Peters CA, Woodruff TK, et al. Индукция циклина D2 в клетках гранулезы крысы требует ФСГ-зависимого ослабления репрессии FOXO1 в сочетании с положительными сигналами от Smad. J. Biol Chem. (2005) 280: 9135–48. DOI: 10.1074 / jbc.M409486200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112.Шен М., Цзян И, Гуань З, Цао И, Сан С. С., Лю Х. ФСГ защищает клетки гранулезы мыши от окислительного повреждения путем подавления митофагии. Научный доклад (2016) 6: 38090. DOI: 10.1038 / srep38090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Шен М., Цзян И, Гуань З., Цао И, Ли Л., Лю Х. и др. Защитный механизм ФСГ против окислительного повреждения в клетках гранулезы яичников мышей путем подавления аутофагии. Аутофагия. (2017) 13: 1364–85. DOI: 10.1080 / 15548627.2017.1327941
PubMed Аннотация | CrossRef Полный текст | Google Scholar
114. Li Z, Zhang P, Zhang Z, Pan B, Chao H, Li L, et al. Система совместного культивирования с преантральными фолликулярными гранулезными клетками in vitro индуцирует мейотическое созревание незрелых ооцитов. Histochem Cell Biol. (2011) 135: 513–22. DOI: 10.1007 / s00418-011-0812-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115. Kalous J, Kubelka M, Šolc P, Šušor A, Motlík J.AKT (протеинкиназа B) участвует в мейотическом созревании ооцитов свиней. Репродукция. (2009) 138: 645–54. DOI: 10.1530 / REP-08-0461
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Хан С.Дж., Ваккари С., Недачи Т., Андерсен С.Б., Ковачина К.С., Рот Р.А. и др. Протеинкиназа B / Akt фосфорилирование PDE3A и его роль в созревании ооцитов млекопитающих. EMBO J. (2006) 25: 5716–25. DOI: 10.1038 / sj.emboj.7601431
PubMed Аннотация | CrossRef Полный текст | Google Scholar
117.Кишимото Т. Праймер по возобновлению мейоза в ооцитах морских звезд: предполагаемый сигнальный путь, запускаемый гормоном, вызывающим созревание. Mol Reproduc Dev. (2011) 78: 704–7. DOI: 10.1002 / mrd.21343
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Casarini L, Lispi M, Longobardi S, Milosa F, La Marca A, Tagliasacchi D, et al. Действие ЛГ и ХГЧ на один и тот же рецептор приводит к количественно и качественно разной внутриклеточной передаче сигналов. PLoS ONE. (2012) 7: e46682. DOI: 10.1371 / journal.pone.0046682
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119. Казарини Л., Санти Д., Бриганте Г., Симони М. Два гормона для одного рецептора: эволюция, биохимия, действия и патофизиология ЛГ и ХГЧ. Endocr Ред. (2018) 2018: 65. DOI: 10.1210 / er.2018-00065
CrossRef Полный текст | Google Scholar
120. Казарини Л., Риччетти Л., Де Паскали Ф., Николи А., Тальявини С., Тренти Т. и др.Фолликулостимулирующий гормон усиливает стероидогенную активность хорионического гонадотропина и антиапоптотическую активность лютеинизирующего гормона в гранулезо-лютеиновых клетках человека in vitro . Mol Cell Endocrinol. (2016) 422: 103–14. DOI: 10.1016 / j.mce.2015.12.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Riccetti L, Sperduti S, Lazzaretti C, Casarini L, Simoni M. Путь цАМФ / PKA: стероидогенез антральной фолликулярной стадии. Майнер Гинеколь. (2018) 2018: 4282. DOI: 10.23736 / S0026-4784.18.04282-X
CrossRef Полный текст | Google Scholar
122. Маккер А., Гоэль М.М., Махди А.А. Сигнальные пути PI3K / PTEN / Akt и TSC / mTOR, дисфункция яичников и бесплодие: обновленная информация. J Mol Endocrinol. (2014) 53: R103–18. DOI: 10.1530 / JME-14-0220
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Насименто А.Р., Мачерони К., Лукас ТФГ, Порту К.С., Лазари МФМ.Перекрестные помехи между ФСГ и релаксином в конце пролиферативной стадии клеток Сертоли крысы. Репродукция. (2016) 152: 613–28. DOI: 10.1530 / REP-16-0330
PubMed Аннотация | CrossRef Полный текст | Google Scholar
124. Meroni SB, Riera MF, Pellizzari EH, Galardo MN, Cigorraga SB. ФСГ активирует сигнальный путь фосфатидилинозитол-3-киназы / протеинкиназы B в 20-дневных клетках Сертоли независимо от IGF-I. J Endocrinol. (2004) 180: 257–65. DOI: 10.1677 / joe.0.1800257
PubMed Аннотация | CrossRef Полный текст | Google Scholar
125. Hunzicker-Dunn M, Maizels E. Пути передачи сигналов FSH в незрелых клетках гранулезы, которые регулируют экспрессию целевого гена: ответвление от протеинкиназы A. Cell Signal. (2006) 18: 1351–9. DOI: 10.1016 / j.cellsig.2006.02.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аменорея: оценка и лечение — Американский семейный врач
1.Комитет по практике Американского общества репродуктивной медицины. Текущая оценка аменореи. Fertil Steril . 2004; 82 (приложение 1): S33–9 ….
2. Американский колледж акушеров и гинекологов. Аменорея (Технический бюллетень ACOG 128). Вашингтон, округ Колумбия: ACOG, 1989.
3. Сперофф Л., Фриц М.А. Аменорея. В кн .: Клиническая гинекологическая эндокринология и бесплодие. 7-е изд. Филадельфия, Пенсильвания: Lippincott Williams & Wilkins, 2005; 401–64.
4.Маршалл WA, Таннер Дж. М.. Вариации паттернов пубертатных изменений у девочек. Арч Дис Детский . 1969; 44: 291–303.
5. Speroff L, Glass RH, Kase NG. Нормальное и ненормальное половое развитие. В кн .: Клиническая гинекологическая эндокринология и бесплодие. 6-е изд. Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс, 1999: 339–79.
6. Кинингем РБ, Апгар Б.С., Schwenk TL. Оценка аменореи. Ам Фам Врач . 1996; 53: 1185–94.
7. Плетчер Дж. Р., Пощечину ГБ. Нарушения менструального цикла. Педиатрическая клиника North Am . 1999; 46: 505–18.
8. Рейндоллар Р.Х., Берд младший, Макдонаф PG. Задержка полового развития: исследование 252 пациентов. Am J Obstet Gynecol . 1981; 140: 371–80.
9. Макивер Б., Романский С.А., Ниппольдт ТБ. Оценка и лечение аменореи. Mayo Clin Proc . 1997; 72: 1161–9.
10.Альбанезе А, Стэнхоуп Р. Исследование задержки полового созревания. Клин Эндокринол (Oxf) . 1995; 43: 105–10.
11. Arojoki M, Йокимаа V, Джуути А, Кошинен П, Ираджала К., Анттила Л. Гипотиреоз среди бесплодных женщин в Финляндии. Гинекол Эндокринол . 2000. 14: 127–31.
12. Калро Б. Нарушение фертильности, вызванное эндокринной дисфункцией у женщин. Endocrinol Metab Clin North Am .2003. 32: 573–92.
13. Лауфер М.Р., Этаж AE, Парсонс К.Э., Кунц К.М., Barbieri RL. Гормональное тестирование у женщин с аменореей в начале взрослой жизни. Гинекол Обстет Инвест . 1995; 40: 200–3.
14. Уоррен MP, Биллер БМ, Шангольд ММ. Новый клинический вариант заместительной гормональной терапии у женщин с вторичной аменореей: влияние циклического введения прогестерона из вагинального геля Crinone с замедленным высвобождением (4% и 8%) на морфологические особенности эндометрия и кровотечение отмены. Am J Obstet Gynecol . 1999. 180 (pt 1): 42–8.
15. Пикетт, Калифорния. Диагностика и лечение опухолей гипофиза: последние достижения. Prim Care . 2003. 30: 765–89.
16. Фольч М, Пигема I, Konje JC. Мюллерова агенезия: этиология, диагностика и лечение. Obstet Gynecol Surv . 2000; 55: 644–9.
17. Селдмейер Иллинойс, Palmert MR. Задержка полового созревания: анализ большой серии случаев из академического центра. Дж. Клин Эндо Метаб . 2002; 87: 1613–20.
18. Traggiai C, Стэнхоуп Р. Задержка полового созревания. Best Practices Clin Endocrinol Metab . 2002; 16: 139–51.
19. Симпсон Дж., Райкович А. Дифференцировка яичников и гонадная недостаточность. Am J Med Genet . 1999; 89: 186–200.
20. Вебстер Дж., Пискителли Г, Полли А, Феррари CI, Исмаил I, Scanlon MF, и другие.Сравнение каберголина и бромокриптина при лечении гиперпролактинемической аменореи. N Engl J Med . 1994; 331: 904–9.
21. Американский колледж акушеров и гинекологов. Бюллетень практики ACOG. Руководство по клиническому ведению акушеров-гинекологов: № 41, декабрь 2002 г. Obstet Gynecol . 2002; 100: 1389–402.
22. Соломон К.Г. Эпидемиология синдрома поликистозных яичников. Распространенность и сопутствующие риски заболеваний. Endocrinol Metab Clin North Am . 1999; 28: 247–63.
23. Чанг Р.Дж., Katz SE. Диагностика синдрома поликистозных яичников. Endocrinol Metab Clin North Am . 1999; 28: 397–408, vii.
24. Мазер К.Дж., Кван Ф, Коренблюм Б. Гиперинсулинемия при синдроме поликистозных яичников коррелирует с повышенным риском сердечно-сосудистых заболеваний независимо от ожирения. Fertil Steril . 2000. 73: 150–6.
25. Velazquez E, Акоста А, Мендоса С.Г.Цикличность менструального цикла после терапии метформином при синдроме поликистозных яичников. Акушерский гинекол . 1997; 90: 392–5.
26. Колодзейчик Б, Дулеба А.Дж., Спачинский Р.З., Павельчик Л. Терапия метформином снижает гиперандрогенизм и гиперинсулинемию у женщин с синдромом поликистозных яичников. Fertil Steril . 2000. 73: 1149–54.
27. Анасти JN. Преждевременная недостаточность яичников: обновленная информация. Fertil Steril .1998; 70: 1–15.
28. Kalantaridou S, Нака К.К., Папаниколау Э, Казакос Н, Краварити М, Калис К.А., и другие. Нарушение функции эндотелия у молодых женщин с преждевременной недостаточностью яичников: нормализация гормональной терапией. Дж. Клин Эндокринол Метаб . 2004; 89: 3907–13.
29. Kalantaridou S, Дэвис С.Р., Нельсон Л.М. Преждевременная недостаточность яичников. Endocrinol Metab Clin North Am .1998. 27: 989–1006.
30. van der Schouw Y, ван дер Грааф Y, Steyerberg EW, Эйкеманс JC, Banga JD. Возраст в период менопаузы как фактор риска смерти от сердечно-сосудистых заболеваний. Ланцет . 1996; 347: 714–8.
31. Якобсен Б.К., Нильссен С, Эй, я, Квале Г. Влияет ли возраст естественной менопаузы на смертность от ишемической болезни сердца? Дж. Клин Эпидемиол . 1997; 50: 475–9.
32.Ким TJ, Анасти JN, Флэк MR, Кимзей Л.М., Дефенсор РА, Нельсон Л.М. Регулярный эндокринный скрининг пациентов с нормальным кариотипом спонтанной преждевременной недостаточности яичников. Акушерский гинекол . 1997. 89 (5 pt 1): 777–9.
33. Миллер К.К., Парулекар М.С., Шенфельд Э, Андерсон Э, Хаббард Дж. Клибански А, и другие. Снижение уровня лептина у женщин с нормальным весом и гипоталамической аменореей: влияние состава тела и приема пищи. Дж. Клин Эндокринол Метаб . 1998; 83: 2309–12.
34. Велт СК, Чан JL, Буллен Дж, Мерфи Р, Смит П., ДеПаоли А.М., и другие. Рекомбинантный человеческий лептин у женщин с гипоталамической аменореей. N Engl J Med . 2004; 351: 987–97.
35. Митан Л.А. Нарушение менструального цикла при нервной анорексии. J Pediatr Adolesc Gynecol . 2004; 17: 81–5.
36. Дринкуотер БЛ, Нильсон К., Отт С, Чеснут CH III.Минеральная плотность костей после возобновления менструации у спортсменов с аменореей. ЯМА . 1986; 256: 380–2.
37. Робинсон Т.Л., Сноу-Хартер С, Таафф ДР, Гиллис Д, Шоу Дж, Маркус Р. Гимнасты демонстрируют более высокую костную массу, чем бегуны, несмотря на одинаковую распространенность аменореи и олигоменореи. J Bone Miner Res . 1995; 10: 26–35.
38. Hergenroeder AC, Смит Е.О., Шыпайло Р, Джонс Л.А., Клиш WJ, Эллис К.Минеральные изменения костной ткани у молодых женщин с гипоталамической аменореей, получавших оральные контрацептивы, медроксипрогестерон или плацебо в течение 12 месяцев. Am J Obstet Gynecol . 1997; 176: 1017–25.
Причины СПКЯ | Центр исследований репродукции
Синдром поликистозных яичников: что вызывает СПКЯ?Хотя он был впервые описан более 65 лет назад, мы до сих пор не знаем точную причину СПКЯ. Теории, касающиеся механизма (ов), включают эффекты аномальной секреции гормонов гипофиза, высоких уровней инсулина и аномального производства мужских гормонов яичниками.
Гипофиз секретирует два гормона, лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ). В целом, ЛГ контролирует выработку женских гормонов (эстрогена и прогестерона) в яичниках, а ФСГ контролирует развитие и высвобождение яйцеклеток в яичниках. ЛГ и ФСГ высвобождаются импульсами из гипофиза в ответ на стимуляцию гонадотропин-рилизинг-гормоном (ГнРГ) из мозга. Секреция ЛГ и ФСГ обычно варьируется в течение менструального цикла, и похоже, что разные паттерны импульсов гонадолиберина из мозга влияют на разные паттерны секреции ЛГ и ФСГ.В частности, быстрые импульсы ГнРГ, по-видимому, способствуют секреции ЛГ, а медленные импульсы ГнРГ способствуют секреции ФСГ. Эстроген и прогестерон из яичников регулируют, как часто мозг секретирует импульсы гонадолиберин, а также количество гонадолиберин, выделяемых за импульс.
Ключевым моментом является то, что импульсы гонадолиберина замедляются из-за повышенных уровней эстрогена и прогестерона, которые обычно возникают после овуляции. Исследования показывают, что это замедление ГнРГ способствует более поздней секреции ФСГ (во время менструации), что обычно приводит к развитию яйцеклеток в следующем цикле.Эти же исследования предполагают, что если импульсы гонадолиберина не замедляются, последующая продукция ФСГ снижается. Таким образом, можно видеть, что эта способность замедлять импульсы гонадолиберина, по-видимому, весьма важна для последующей секреции ФСГ и, следовательно, для последующего развития яйцеклетки.
Исследования показали, что секреция ГнРГ у пациентов с СПКЯ относительно быстрая и не очень хорошо замедляется в ответ на эстроген и прогестерон. Мы считаем, что это помогает объяснить, почему у пациентов с СПКЯ часто не происходит овуляция.У женщин с СПКЯ часто наблюдается высокий уровень секреции ЛГ. Высокий уровень ЛГ способствует высокому уровню андрогенов (мужских гормонов, таких как тестостерон), и это наряду с низким уровнем ФСГ способствует плохому развитию яйцеклеток и неспособности к овуляции. Отсутствие овуляции также приводит к относительному дефициту выработки прогестерона яичниками, что часто приводит к отсутствию менструального цикла.
Гипофиз: анатомия и функция основной железы
Home Лечение Гипофиз: анатомия и функция главной железыПочему гипофиз называют главной железой?
Гипофиз находится на перекрестке анатомических и функциональных путей мозга, разума и тела.При весе менее одного грамма и ширине сантиметра гипофиз часто называют «главной железой», поскольку он регулирует секрецию гормонов организма.
Эти вещества, попадая гипофизом в кровоток, оказывают драматическое и широкое воздействие на рост и развитие, сексуальность и репродуктивную функцию, обмен веществ, реакцию на стресс и общее качество жизни.
Анатомия и функция гипофиза
Эта небольшая бобовидная железа расположена ниже мозга в основании черепа, в области, называемой турецким седлом.Гипофиз регулируется областью мозга, называемой гипоталамусом, которая связана с гипофизом тонким тонким сосудистым соединением, называемым стеблем гипофиза или воронкой.
Гипофиз делится на большую переднюю область (аденогипофиз) и меньшую заднюю область (нейрогипофиз). Прямо над гипофизом находятся зрительные нервы и перекрест зрительных нервов, выступающие к глазам.
По обе стороны от гипофиза расположены кавернозные синусы, представляющие собой венозный канал, через который проходят сонные артерии, несущие кровь к мозгу, и важные нервы, контролирующие движения глаз и лицевые ощущения.
Из-за близости гипофиза к этим основным внутричерепным нервам и кровеносным сосудам, а также из-за жизненно важного гормонального контроля, обеспечиваемого гипофизом, расстройства гипофиза могут вызывать широкий спектр симптомов, как гормональных, так и неврологических.
Гипофиз и связанные с ним структурыКраткий обзор гормонального дефицита
*Гормон роста (GH):
Это главный гормон, который, помимо многих других функций, регулирует развитие тела и мозга, созревание костей, обмен веществ и необходим для здоровья мышц.
Дети: Задержка роста
Взрослые: Снижение мышечной массы, увеличение жировых отложений, повышенный холестерин, низкая плотность костей (остеопороз), нарушение психологического самочувствия, плохое качество жизни
Рекомбинантный гормон роста человека — вводится один раз в день в виде инъекции под кожу
Лютеинизирующий гормон (Lh) и фолликулостимулирующий гормон (ФСГ):
Эти гормоны контролируют выработку половых гормонов (эстрогена и тестостерона), а также созревание и выделение сперматозоидов и яйцеклеток.
Снижение либидо, эректильная дисфункция, нерегулярные или отсутствующие менструации, уменьшение волос на теле, снижение мышечной силы, приливы, изменения настроения
Мужчины: Тестостерон — в виде геля для местного применения, пластыря или инъекций
Женщины: Эстроген + прогестерон Принимается в виде пластыря для местного применения или таблеток
Адренокортикотропный гормон (АКТГ):
Этот гормон заставляет надпочечники (расположенные над почками) выделять гормон кортизол, который, в свою очередь, регулирует метаболизм углеводов, жиров и белков и играет важную роль в реакции на стресс.
Плохой аппетит, тошнота, слабость, рвота, низкий уровень сахара в крови, низкое кровяное давление, головокружение, ломота в теле
Гидрокортизон или преднизон в виде таблеток для ежедневного приема
Гормон, стимулирующий щитовидную железу (ТТГ):
Этот гормон стимулирует выработку гормонов щитовидной железы в щитовидной железе. Гормоны щитовидной железы контролируют базовую скорость метаболизма и играют важную роль в росте и созревании. Гормоны щитовидной железы поражают почти все органы тела.
Усталость, слабость, непереносимость холода, сухость кожи, запор, обильные / болезненные менструации, увеличение веса, потеря памяти, нарушение настроения
Левотироксин: Принимается в виде таблеток для ежедневного приема (некоторые примеры включают Synthroid, Levoxyl, Levothroid или Armor Thyroid)
Пролактин (PRL):
Этот гормон стимулирует секрецию грудного молока.
Вазопрессин — также называется антидиуретическим гормоном (АДГ):
Этот гормон способствует реабсорбции воды почками и, таким образом, необходим для водно-электролитного баланса.
Повышенная жажда и частое мочеиспускание
DDAVP: Принимается в виде таблеток для ежедневного приема или назального спрея
* При болезненных состояниях гипофиз может производить недостаточное или избыточное количество гормонов. Снижение выработки гормонов гипофиза называется гипопитуитаризмом или гипофизарной недостаточностью.Симптомы и лечение специфического гормонального дефицита описаны ниже.
Написано и отрецензировано:
Медицинская и редакционная группа Pacific NeuroscienceМы — высокоспециализированная команда медицинских специалистов, обладающих обширными знаниями в области неврологии и черепно-мозговых заболеваний, а также опытом и письменным опытом.
Последнее обновление: 6 ноября 2020 г.
