В новый микроскоп IBM видно межатомные связи в молекуле / Хабр
Научно-исследовательское подразделение IBM Research в Цюрихе опубликовало картинки, которые удалось сгенерировать с помощью сканирующего атомно-силового микроскопа (АСМ). На изображениях можно различить отдельные атомы углерода в шарообразной молекуле C60. Видны даже химические связи между атомами, то есть перекрывающиеся электронные облака («размазанные» электроны, в терминологии Шрёдингера).
В 2009 году именно эта группа учёных IBM впервые получила фотографию отдельной молекулы: вот этот исторический снимок молекулы пентацена из пяти бензольных колец. Та фотография была сделана при температуре 5°K в сверхвысоком вакууме.
Сейчас учёные значительно увеличили разрешение АСМ, хотя работает он на прежнем принципе. На конце чувствительной головки АСМ помещена отдельная молекула угарного газа (CO), которая раскачивается над сканируемой поверхностью. При приближении к «чужим» атомам наша молекула испытывает силы притяжения и слегка меняет амплитуду покачиваний.
Замеряя изменения в амплитуде, АСМ рисует изображение сканируемой поверхности с невероятным разрешением 3 пикометра (3 × 10-12 м), что чуть больше 1/100 от диаметра атома углерода. Синие и зелёные цвета на «фотографии» — это условность.
Столь высокая разрешающая способность микроскопа открывает удивительные перспективы: мы можем своими глазами увидеть, как происходят химические реакции на молекулярном уровне, а также лучше изучить структуру материалов с уникальными свойствами, таких как графен. Теоретически было известно, что атомы углерода в графене и других веществах находятся на разном расстоянии друг от друга и отличаются силой связей: если в том же графене они сильные, то в молекулах, например, ароматических углеводородов связи гораздо слабее, хотя атомная решётка там похожей гексагональной формы. Теперь мы можем своими глазами увидеть эту разницу.
Лучшее изучение молекулярной структуры продвинет вперёд исследования новых материалов и позволит создать более эффективные органические фотоэлементы, органические светодиоды (OLED) и другие материалы.
Результаты исследования IBM Research опубликованы в журнале Science.
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула
https://ria.ru/20190729/1556966223.html
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула — РИА Новости, 29.07.2019
Мощные лазеры помогли ученым увидеть, как вращается одиночная молекула
Датские и немецкие физики впервые сняли на видео то, как вращается одиночная молекула, состоящая из трех разных атомов, и сравнили эти наблюдения с… РИА Новости, 29.07.2019
2019-07-29T13:11
2019-07-29T13:11
2019-07-29T13:11
наука
германия
открытия — риа наука
физика
атомы
молекулы
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155696/38/1556963841_32:16:2000:1123_1920x0_80_0_0_154e96d345c763a17c148af3a9ae6835. jpg
jpg
МОСКВА, 29 июл – РИА Новости. Датские и немецкие физики впервые сняли на видео то, как вращается одиночная молекула, состоящая из трех разных атомов, и сравнили эти наблюдения с предсказаниями теории. Их выводы были опубликованы в журнале Nature Communications.В последние годы, благодаря постройке мощных рентгеновских лазеров, способных вырабатывать пучки света с огромной скоростью, ученые смогли заглянуть в самые далекие глубины мира молекул и элементарных частиц. К примеру, в начале этого десятилетия они получили первые «атомные» фотографии вирусов и белков. В последующие годы физики смогли снять химическую реакцию на видео, сфотографировать электроны внутри алмаза, а также получить первые фотоснимки одиночной водородной связи, играющей ключевую роль в формировании белковых молекул, ДНК и других «молекул жизни».Все эти достижения, как отмечает Кюппер, не позволяли ученым решить более простую задачу – увидеть то, как вращается молекула и меняет свою структуру в ходе взаимодействий с соседями или во время простых химических реакций.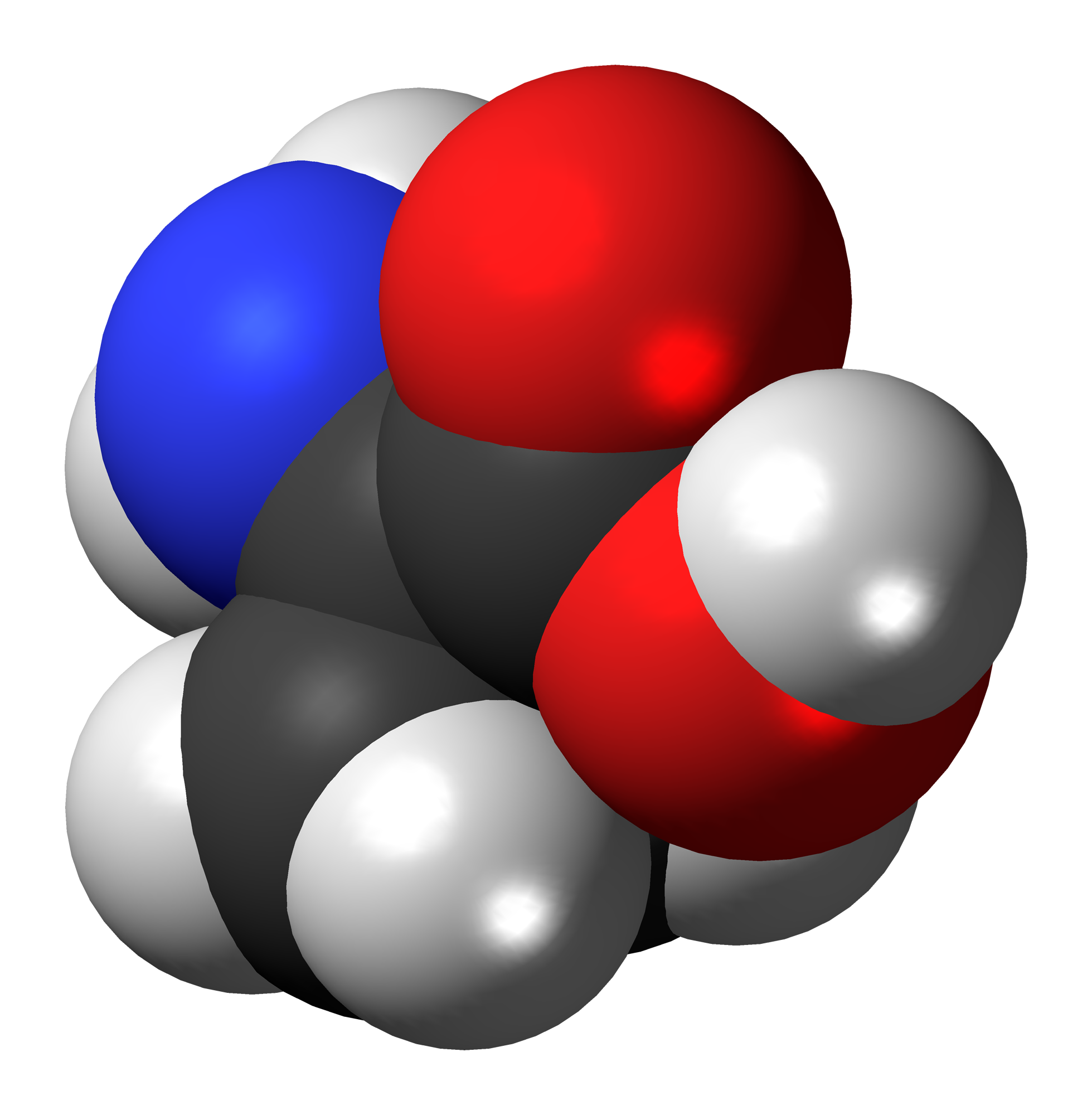 Этому мешало то, что рентгеновские лазеры разрушают изучаемую молекулу практически сразу после того, как импульс света пролетает через нее.Немецкие физики нашли остроумное решение для этой проблемы, используя не одну, а несколько сотен молекул, два разных типа лазеров, а также определенные закономерности квантовой механики, упростившие им задачу.В качестве первого «подопытного» ученые избрали сульфоксид углерода – вещество, состоящее из атомов углерода, серы и кислорода, соединенных прочными ковалентными связями. Подготовив облако из подобных молекул, физики пропустили через него два очень коротких импульса инфракрасного лазера.Пауза между этими вспышками света была подобрана таким образом, что она была короче, чем тот промежуток времени, которое сульфоксид углерода тратит на совершение одного оборота вокруг своей оси. Благодаря этому, вращение всех молекул, через которые проходили обе вспышки света, синхронизировалось под действием принципов квантовой механики.Это позволило ученым получить набор из фактически одинаковых молекул, каждую из которых они обстреливали второй, более мощной вспышкой света, позволявшей им увидеть это вещество, но разрушавшей его при контакте.
Этому мешало то, что рентгеновские лазеры разрушают изучаемую молекулу практически сразу после того, как импульс света пролетает через нее.Немецкие физики нашли остроумное решение для этой проблемы, используя не одну, а несколько сотен молекул, два разных типа лазеров, а также определенные закономерности квантовой механики, упростившие им задачу.В качестве первого «подопытного» ученые избрали сульфоксид углерода – вещество, состоящее из атомов углерода, серы и кислорода, соединенных прочными ковалентными связями. Подготовив облако из подобных молекул, физики пропустили через него два очень коротких импульса инфракрасного лазера.Пауза между этими вспышками света была подобрана таким образом, что она была короче, чем тот промежуток времени, которое сульфоксид углерода тратит на совершение одного оборота вокруг своей оси. Благодаря этому, вращение всех молекул, через которые проходили обе вспышки света, синхронизировалось под действием принципов квантовой механики.Это позволило ученым получить набор из фактически одинаковых молекул, каждую из которых они обстреливали второй, более мощной вспышкой света, позволявшей им увидеть это вещество, но разрушавшей его при контакте.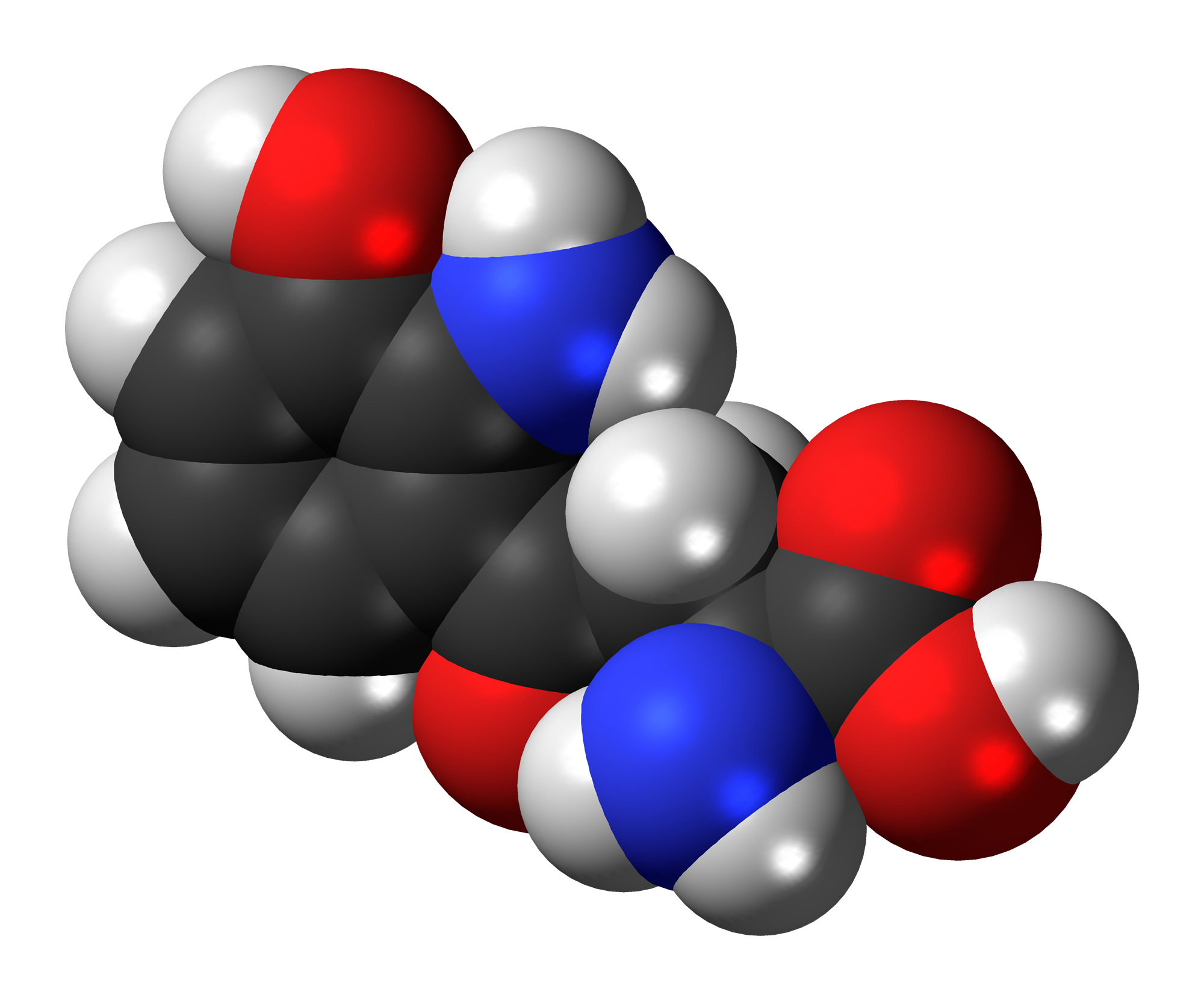 «Подсвечивая» каждую копию сульфоксида углерода в «пачке», физики смогли получить короткое видео из 650 кадров, на котором можно увидеть то, как эта молекула совершает полтора оборота вокруг своей оси. На один такой оборот, как показали ученые, она тратит 82 пикосекунды, триллионных долей секунды.В целом, результаты этого эксперимента полностью совпали с результатами компьютерных расчетов. Это говорит о том, что физики достаточно хорошо понимают то, как устроены молекулы и какие законы мироздания управляют их вращением. В ближайшее время Кюппер и его команда планируют применить эту методику для изучения различных «закрученных» молекул, чья форма влияет на характер их взаимодействий с другими веществами. Яркий пример этого – аминокислоты и сахара в нашем теле, присутствующие в нем в исключительно «правой» и «левой» конфигурации.
«Подсвечивая» каждую копию сульфоксида углерода в «пачке», физики смогли получить короткое видео из 650 кадров, на котором можно увидеть то, как эта молекула совершает полтора оборота вокруг своей оси. На один такой оборот, как показали ученые, она тратит 82 пикосекунды, триллионных долей секунды.В целом, результаты этого эксперимента полностью совпали с результатами компьютерных расчетов. Это говорит о том, что физики достаточно хорошо понимают то, как устроены молекулы и какие законы мироздания управляют их вращением. В ближайшее время Кюппер и его команда планируют применить эту методику для изучения различных «закрученных» молекул, чья форма влияет на характер их взаимодействий с другими веществами. Яркий пример этого – аминокислоты и сахара в нашем теле, присутствующие в нем в исключительно «правой» и «левой» конфигурации.
https://ria.ru/20170513/1494214972.html
https://ria.ru/20120829/733143098.html
германия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155696/38/1556963841_0:0:2000:1500_1920x0_80_0_0_89d7860c34f0a565ca54a3bf38461fd9.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
германия, открытия — риа наука, физика, атомы, молекулы
МОСКВА, 29 июл – РИА Новости. Датские и немецкие физики впервые сняли на видео то, как вращается одиночная молекула, состоящая из трех разных атомов, и сравнили эти наблюдения с предсказаниями теории. Их выводы были опубликованы в журнале Nature Communications.
Датские и немецкие физики впервые сняли на видео то, как вращается одиночная молекула, состоящая из трех разных атомов, и сравнили эти наблюдения с предсказаниями теории. Их выводы были опубликованы в журнале Nature Communications.«Физики давно мечтали, что мы сможем запечатлеть движение атомов в каких-то сверхбыстрых процессах. Сделать это сложно, так как молекулы вращаются совсем не так, как это делает набор из шариков и палочек. Их движением управляют законы квантовой механики — положение и импульс каждого атома нельзя точно измерить», — объясняет Йохен Кюппер (Jochen Kuepper) из Гамбургского университета (Германия).
В последние годы, благодаря постройке мощных рентгеновских лазеров, способных вырабатывать пучки света с огромной скоростью, ученые смогли заглянуть в самые далекие глубины мира молекул и элементарных частиц. К примеру, в начале этого десятилетия они получили первые «атомные» фотографии вирусов и белков.
В последующие годы физики смогли снять химическую реакцию на видео, сфотографировать электроны внутри алмаза, а также получить первые фотоснимки одиночной водородной связи, играющей ключевую роль в формировании белковых молекул, ДНК и других «молекул жизни».
Все эти достижения, как отмечает Кюппер, не позволяли ученым решить более простую задачу – увидеть то, как вращается молекула и меняет свою структуру в ходе взаимодействий с соседями или во время простых химических реакций. Этому мешало то, что рентгеновские лазеры разрушают изучаемую молекулу практически сразу после того, как импульс света пролетает через нее.
Немецкие физики нашли остроумное решение для этой проблемы, используя не одну, а несколько сотен молекул, два разных типа лазеров, а также определенные закономерности квантовой механики, упростившие им задачу.
В качестве первого «подопытного» ученые избрали сульфоксид углерода – вещество, состоящее из атомов углерода, серы и кислорода, соединенных прочными ковалентными связями. Подготовив облако из подобных молекул, физики пропустили через него два очень коротких импульса инфракрасного лазера.
Пауза между этими вспышками света была подобрана таким образом, что она была короче, чем тот промежуток времени, которое сульфоксид углерода тратит на совершение одного оборота вокруг своей оси. Благодаря этому, вращение всех молекул, через которые проходили обе вспышки света, синхронизировалось под действием принципов квантовой механики.
Благодаря этому, вращение всех молекул, через которые проходили обе вспышки света, синхронизировалось под действием принципов квантовой механики.
Это позволило ученым получить набор из фактически одинаковых молекул, каждую из которых они обстреливали второй, более мощной вспышкой света, позволявшей им увидеть это вещество, но разрушавшей его при контакте.
«Подсвечивая» каждую копию сульфоксида углерода в «пачке», физики смогли получить короткое видео из 650 кадров, на котором можно увидеть то, как эта молекула совершает полтора оборота вокруг своей оси. На один такой оборот, как показали ученые, она тратит 82 пикосекунды, триллионных долей секунды.
В целом, результаты этого эксперимента полностью совпали с результатами компьютерных расчетов. Это говорит о том, что физики достаточно хорошо понимают то, как устроены молекулы и какие законы мироздания управляют их вращением.
Это говорит о том, что физики достаточно хорошо понимают то, как устроены молекулы и какие законы мироздания управляют их вращением.
В ближайшее время Кюппер и его команда планируют применить эту методику для изучения различных «закрученных» молекул, чья форма влияет на характер их взаимодействий с другими веществами. Яркий пример этого – аминокислоты и сахара в нашем теле, присутствующие в нем в исключительно «правой» и «левой» конфигурации.
29 августа 2012, 21:02НаукаРентгеновский лазер помог физикам взглянуть на электроны внутри алмазаФизики использовали сверхмощный рентгеновский лазер LCLS для получения первых фотоснимков отдельных электронов, обращающихся вокруг атомов углерода в кристалле алмаза, и опубликовали результаты своей работы в статье в журнале Nature.Фотография атома в электронном микроскопе. Ученые впервые увидели атом «вживую»
 Победителя объявят уже 7 октября,
а выставка лучших работ пройдет с 7 октября по 5 января в Музее науки в Лондоне.
Победителя объявят уже 7 октября,
а выставка лучших работ пройдет с 7 октября по 5 января в Музее науки в Лондоне.Редакция ПМ
«Структура мыльного пузыря», автор Ким Кокс
Мыльные пузыри оптимизируют пространство внутри себя и минимизируют площадь их поверхности для заданного объема воздуха. Это делает их полезным объектом исследования во многих областях, в частности, в области материаловедения. Стенки пузырьков как бы стекают под действием силы тяжести: они тонкие вверху и толстые внизу.
«Разметка на молекулах кислорода», Ясмин Кроуфорд
Снимок входит в последний крупный проект автора в рамках магистерской работе по фотографии в университете Фалмута, где основное внимание уделялось исследованию миалгического энцефаломиелита. Кроуфорд говорит, что создает образы, которые связывают нас с неоднозначным и неизвестным.
«Спокойствие вечности», автор Евгений Самученко
Снимок сделан в Гималаях на озере Госаикунда на высоте 4400 метров./illustration-of-properties-and-molecular-structure-of-water-consisting-of-two-hydrogen-atoms-covalently-bonded-to-single-oxygen-atom-85594579-583b267c5f9b58d5b1b9e84b-5bc4c2ea46e0fb0026923ba3.jpg)
«Смущенный мучной жук», автор Дэвид Спирс
Этот маленький жук-вредитель заводится зерновых и мучных изделиях. Изображение было получено с помощью сканирующей электронной микрофотографии, а затем окрашено в Photoshop.
«Туманность «Северная Америка», Дэйв Уотсон
Туманность «Северная Америка» NGC7000 — это эмиссионная туманность в созвездии Лебедя. Форма туманности напоминает форму Северной Америки — можно увидеть даже Мексиканский залив.
«Жук-олень», автор Виктор Сикора
Фотограф использовал световую микроскопию с увеличением в пять раз.
«Телескоп Ловелла», автор Мардж Брэдшоу
«Я была очарована телескопом Ловелла в Джодрелл Бэнк с тех пор, как увидела ее на школьной экскурсии», — говорит Брэдшоу. Она хотела сделать несколько более детальных фотографий, чтобы показать его износ.
«Медузы вверх ногами», автор Мэри Энн Чилтон
Вместо того, чтобы плавать, этот вид проводит время, пульсируя в воде. Цвет медуз — результат поедания водорослей.
Физикам из США удалось запечатлеть на фото отдельные атомы с рекордным разрешением, передает Day.Az со ссылкой на Vesti.ru
Ученым из Корнеллского университета в США удалось запечатлеть на фото отдельные атомы с рекордным разрешением — меньше половины ангстрема (0,39 Å). Предыдущие фотографии обладали вдвое низким разрешением — 0,98 Å.
Мощные электронные микроскопы, способные увидеть атомы, существуют уже полвека, однако их разрешающая способность ограничена длинной волны видимого света, которая больше диаметра атома средней величины.
Поэтому ученые используют некий аналог линз, фокусирующих и увеличивающих изображение в электронных микроскопах — им выступает магнитное поле. Однако колебания магнитного поля искажают полученный результат. Чтобы убрать искажения, используют дополнительные устройства, которые корректируют магнитное поле, но вместе с тем увеличивают сложность конструкции электронного микроскопа.
Ранее физики из Корнеллского университета разработали устройство Electron Microscope Pixel Array Detector (EMPAD), заменяющее сложную систему генераторов, фокусирующих входящие электроны одной небольшой матрицей с разрешением 128х128 пикселей, чувствительных к отдельным электронам. Каждый пиксель регистрирует угол отражения электрона; зная его, ученые при помощи техники птайкографии реконструируют характеристики электронов, включая координаты точки, откуда он был выпущен.
Атомы в самом большом разрешении
David A. Muller et al. Nature, 2018.
Летом 2018 года физики решили улучшить качество получаемых снимков до рекордного до сегодняшнего дня разрешения. Ученые закрепили на подвижной балке лист 2D материала — сульфида молибдена MoS2, и выпустили пучки электронов, поворачивая балку под разными углами к источнику электронов. С помощью EMPAD и птайкографии ученые определили расстояния между отдельными атомами молибдена и получили изображение с рекордным разрешением — 0,39 Å.
«Практически мы создали самую маленькую в мире линейку», — объясняет Сол Грюнер (Sol Gruner), один из авторов эксперимента. На полученном снимке удалось разглядеть атомы серы с рекордным разрешением 0,39 Å. Причем удалось даже разглядеть место, где одного такого атома не хватает (указано стрелочкой).
Атомы серы в рекордном разрешении
До сих пор ученые могли только предполагать наличие молекулярных структур. Сегодня же с помощью атомно-силовой микроскопии, отдельные атомные связи (каждая несколько десятков миллионных долей миллиметра длиной), соединяющие молекулу (26 атомов углерода и 14 атомов водорода), можно увидеть довольно четко.
Первоначально, команда хотела работать со структурами из графена, однослойного материала, в котором атомы углерода расположены в виде шестиугольников. Формируя соты углерода, атомы перестраиваются из линейной цепи в шестигранники; эта реакция может давать несколько различных молекул.
Феликс Фишер, химик Калифорнийского университет в Беркли, и его коллеги хотели визуализировать молекулы, чтобы убедиться, что все сделали правильно.
Кольчатая, углеродсодержащая молекула, показанная до и после реорганизации с двумя наиболее распространенными продуктами реакции, проходившей при температуре выше 90 градусов Цельсия. Размер: 3 ангстрема или трех-десяти миллиардная доля метра в поперечнике.
Чтобы задокументировать рецепт графена, Фишеру было необходимо мощное устройство обработки изображений, и он обратился к атомно-силовому микроскопу, который был у Майкла Кромми из лаборатории Калифорнийского университета.
Бесконтактная атомно-силовая микроскопия (NC-AFM) использует очень тонкий и чувствительный датчик, чтобы почувствовать электрическую силу, создаваемую молекулами. Кончик перемещается вблизи поверхности молекулы, испытывая отклонения разными зарядами, создавая образ того, как перемещаются атомы.
Одноатомный кончик бесконтактного атомно-силового микроскопа «прощупывает» поверхность с помощью острой иглы. Игла движется по поверхности исследуемого объекта подобно тому, как игла фонографа проходит по желобкам пластинки. Кроме атомов, возможно «прощупывать» и атомные связи
Кроме атомов, возможно «прощупывать» и атомные связи
Так команде удалось не только визуализировать атомы углерода, но и связи между ними, созданные общими электронами. Они поместили кольчатые структуры углерода на серебренную пластину и нагрели ее, чтобы реорганизовать молекулу. Охлажденные продукты реакции, содержали три неожиданных продукта и только одну молекулу, ожидаемую учеными.
В молекуле воды главным действующим лицом является атом кислорода.
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород — кислород не прямой (90°), а немного больше — 104,5°.
Химические связи в молекуле воды – полярные, так как кислород подтягивает к себе отрицательно заряженные электроны, а водород — положительно заряженные электроны. В результате вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода — положительный.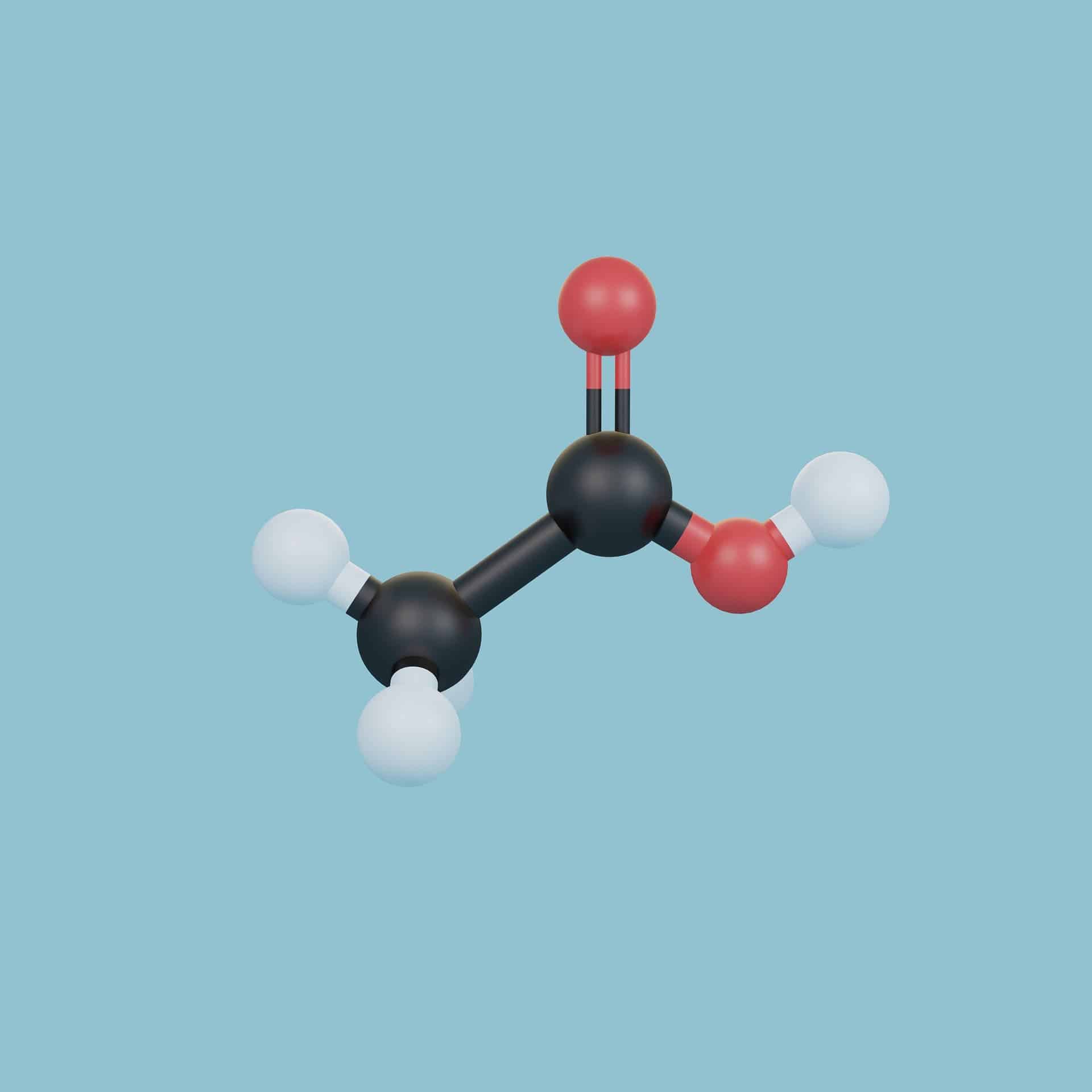
Поэтому вся молекула воды является диполем, то есть молекулой с двумя разноименными полюсами. Дипольная структура молекулы воды во многом определяет ее необычные свойства.
Молекула воды – это диамагнетик.
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — тетраэдр. Таково строение самой молекулы воды.
При изменении состояния молекулы воды длина сторон и угол между ними изменяются в тетраэдре.
Например, если молекула воды находится в парообразном состоянии, то угол, образованный ее сторонами, равняется 104°27″. В водном состоянии угол составляет 105°03″. И в состоянии льда угол равен 109,5°.
Геометрия и размеры молекулы воды для различных состояний
а — для парообразного состояния
б — для низшего колебательного уровня
в — для уровня, близкого к образованию кристалла льда, когда геометрия молекулы воды соответствует геометрии двух египетских треугольников с соотношением сторон 3: 4: 5
г — для состояния льда.
Если разделить пополам эти углы, то получим углы:
104°27″: 2 = 52°13″,
105°03″: 2 = 52°31″,
106°16″: 2 = 53°08″,
109,5°: 2 = 54°32″.
Значит, среди геометрических рисунков молекулы воды и льда находится знаменитый египетский треугольник, в основу построения которого заложены соотношения золотой пропорции — длины сторон относятся как 3:4:5 с углом 53°08″.
Молекула воды приобретает строение золотой пропорции на пути, когда вода переходит в лед, и наоборот, когда лед тает. Очевидно, за это состояние и ценится талая вода, когда ее структура в построении имеет пропорции золотого сечения.
Теперь становится понятным, что знаменитый египетский треугольник с соотношением сторон 3:4:5 «взят» из одного из состояний молекулы воды. Сама же геометрия молекулы воды образована двумя египетскими прямоугольными треугольниками, имеющими общий катет равный 3.
Молекула воды, имеющая в основе соотношение золотой пропорции, является физическим проявлением Божественной Природы, которая участвует в создании жизнь. Именно поэтому в земной природе заложена та гармония, которая присуща всему космосу.
Именно поэтому в земной природе заложена та гармония, которая присуща всему космосу.
И поэтому древние египтяне обожествляли числа 3, 4, 5, а сам треугольник считали священным и старались заложить его свойства, его гармонию в любую конструкцию, дома, пирамиды и даже в разметку полей. Кстати, украинские хаты строились тоже с применением соотношения золотой пропорции.
В пространстве молекула воды занимает некоторый объем, и покрыта электронной оболочкой в виде вуали. Если представить вид гипотетической модели молекулы в плоскости, то она похожа на крылья бабочки, на Х-образную хромосому, в которой записана программа жизни живого существа. И это является показательным фактом того, что сама вода — это обязательный элемент всего живого.
Если представить вид гипотетической модели молекулы воды в объеме, то она передает форму треугольной пирамиды, у которой имеется 4 грани, а у каждой грани по 3 ребра. В геометрии треугольная пирамида называется тетраэдром. Такое строение свойственно кристаллам.
Таким образом, молекула воды образует прочную уголковую структуру, которую она сохраняет даже, когда находится в парообразном состоянии, на грани перехода в лед, и когда превращается в лед.
Если «скелет» молекулы воды так устойчив, то и его энергетическая «пирамида» — тетраэдр тоже стоит непоколебимо.
Такие структурные свойства молекулы воды в различных условиях объясняются прочными связями между двумя атомами водорода и одним атомом кислорода. Эта связь примерно в 25 раз сильнее, чем связь между соседними молекулами воды. Поэтому легче отделить одну молекулу воды от другой, например, при нагревании, чем разрушить саму молекулу воды.
За счет ориентационных, индукционных, дисперсионных взаимодействий (сил Ван-дер-Ваальса) и водородных связей между атомами водорода и кислорода соседних молекул молекулы воды способны образовывать как случайные ассоциаты, т.е. не имеющие упорядоченной структуры, так и кластеры – ассоциаты, имеющие определенную структуру.
Согласно статистическим данным, в обычной воде находится случайных ассоциатов — 60% (деструктурированная вода) и кластеров — 40% (структурированная вода).
В результате исследований, проведенных российским ученым С. В. Зениным, были обнаружены стабильные долгоживущие кластеры воды.
Зенин установил, что молекулы воды первоначально образуют додекаэдр. Четыре додекаэдра соединяясь, образует основной структурный элемент воды — кластер, состоящий из 57 молекул воды.
В кластере додекаэдры имеют общие грани, а их центры образуют правильный тетраэдр. Это объёмное соединение молекул воды, в том числе гексамеров, которое имеет положительные и отрицательные полюса.
Водородные мостики позволяют молекулам воды объединяться самыми различными способами. Благодаря этому в воде наблюдается бесконечное разнообразие кластеров.
Кластеры могут взаимодействовать друг с другом за счет свободных водородных связей, что приводит к появлению структур второго порядка в виде шестигранников. Они состоят из 912 молекул воды, которые практически не способны к взаимодействию. Время существования такой структуры весьма велико.
Эту структуру, похожую на маленький острый кристаллик льда из 6 ромбических граней, С.В. Зенин назвал «основным структурным элементом воды”. Многочисленные эксперименты подтвердили; в воде — мириады таких кристалликов.
Эти кристаллики льда почти не взаимодействуют друг с другом, поэтому не образуют более сложных устойчивых конструкций и легко скользят гранями относительно друг друга, создавая текучесть. В этом смысле вода напоминает переохлажденный раствор, который никак не может кристаллизоваться.
%d0%b0%d1%82%d0%be%d0%bc PNG, векторы, PSD и пнг для бесплатной загрузки
green environmental protection pattern garbage can be recycled green clean
2000*2000
be careful to slip fall warning sign carefully
2500*2775
blue series frame color can be changed text box streamer
1024*1369
break split orange be
2000*2000
в первоначальном письме векторный дизайн логотипа шаблон
1200*1200
буква bc 3d логотип круг
1200*1200
логотип bc
1200*1200
сложный современный дизайн логотипа с биткойн символами и буквами bc
8331*8331
bc beauty косметический логотип дизайн вектор
8542*8542
82 летняя годовщина векторный дизайн шаблона иллюстрация
4083*4083
год до н э письмо логотип
1200*1200
3d золотые числа 82 с галочкой на прозрачном фоне
1200*1200
номер 82 золотой шрифт
1200*1200
bc логотип шаблон
1200*1200
asmaul husna 82
2020*2020
be careful warning signs warning signs be
2000*2000
дизайн логотипа bc значок буквы b
8333*8333
логотип готов использовать год до н э
6667*6667
Векторный шрифт алфавит номер 82
1200*1200
be careful warning signs warning signs be
2000*2000
год до н э письмо логотип
1200*1200
82 летний юбилей ленты
5000*3000
золото смешанное с зеленым в 3д числах 82
1200*1200
черный градиент 3d номер 82
1200*1200
82 летняя годовщина логотип дизайн шаблона иллюстрацией вектор
4083*4083
Современный и уникальный логотип о письме bc bluechip или процессор eps10 вектор
3000*3000
82 летняя годовщина векторный дизайн шаблона иллюстрация
4083*4083
be careful be careful meet beware
1024*1369
82 летняя годовщина векторный дизайн шаблона иллюстрация
4167*4167
корейский традиционный бордюр 82
1200*1200
год до н э письмо логотип
1200*1200
текстура шрифт стиль золотой тип число 82
1200*1200
глюк числа 82 вектор на прозрачном фоне
2500*2500
Золотая буква b логотип bc письмо дизайн вектор с золотыми цветами
8334*8334
корпоративная современная синяя минимальная визитная карточка 82
1200*1200
номер 82 3d рендеринг
2000*2000
номер 82 крутой 3d градиент текстовый эффект прозрачный фон
1200*1200
год до н э письмо логотип
1200*1200
have electricity prohibit be careful be
2000*2000
82 лет коробки лента годовщина
5000*3000
82 летний юбилей ленты
5000*3000
82 лет юбилей празднования вектор шаблон дизайн иллюстрация
4187*4187
событие простого элемента 82
1200*1200
3d числа 82 в круге на прозрачном фоне
1200*1200
почерк асмаул хана номер 82
2500*2500
82 летний юбилей ленты
5000*3000
глюк числа 82 вектор на прозрачном фоне
1200*1200
82 лет коробки лента годовщина
5000*3000
be happy be happy play girl
2000*2000
год до н э письмо логотип
1200*1200
Строение вещества — урок. Физика, 7 класс.
Мельчайшей частицей вещества, которая определяет все свойства данного вещества, является молекула.
Молекула состоит из атомов. Число атомов и их распределение в молекуле является различным. В природе существует немногим более сотни атомов различного вида. Элементы обобщены и расположены в периодической таблице химических элементов, им даны наименования, например: водород, азот, углерод.
Рис. \(1\). Таблица Менделеева
Молекулы одного и того же вещества одинаковы.
Например, молекула воды состоит из двух атомов водорода и одного атома кислорода.
Рис. \(2\). Молекула
Молекулы вещества находятся в непрерывном движении.
Движение частиц вещества называют тепловым движением.
Чем выше температура вещества, тем быстрее движение молекул.
Твёрдые вещества
В твёрдых веществах атомы или молекулы расположены близко друг к другу, и в результате их взаимодействия могут происходить только колебательные движения около определённой точки.
Рис. \(2\). Расположение молекул в твёрдых телах
В твёрдых кристаллических веществах атомы расположены в определённом порядке и образуют кристаллическую решётку. Кристаллическим веществом является поваренная соль (атомы натрия — красного цвета, атомы хлора — синего).
Рис. \(3\). Кристаллическая решётка
В твёрдых аморфных веществах атомы расположены беспорядочно. Аморфными веществами являются смола, янтарь.
В жидкостях расстояние между молекулами больше, чем в твёрдых веществах, и движение молекул свободнее.
Рис. \(4\). Расположение молекул воды
Молекулы газа находятся на больших расстояниях друг от друга. Поэтому взаимодействие молекул газа не учитывается. Пространство между молекулами позволяет сильно сжимать газы.
Рис. \(5\). Молекулы водяного пара
Другие видеоуроки по школьной программе смотрите на InternetUrok.ru
Газ не имеет своей формы. Газ заполняет весь предоставленный объём, легко смешивается с другими газами. Энергия газа заключена в скорости движения его молекул. Каждая молекула пролетает большое расстояние, прежде чем столкнётся с другой молекулой или стенкой сосуда. Если молекулы находятся на очень большом расстоянии, то силы между ними уже не действуют.
Интересное видео «Взаимодействие молекул»:
Другие видеоуроки по школьной программе смотрите на InternetUrok.ru
Источники:
Рис. 3. Кристаллическая решётка. © ЯКласс.
Ученые впервые увидели атом «вживую»
Атом водорода, запечатлев электронные облака. И хотя современные физики с помощью ускорителей могут определять даже форму протона, атом водорода, по-видимому, так и останется самым мелким объектом, изображение которого имеет смысл называть фотографией. «Лента.ру» представляет обзор современных методов фотографирования микромира.
Строго говоря, обычной фотографии в наши дни почти не осталось. Изображения, которые мы по привычке называем фотографиями и можем найти, к примеру, в любом фоторепортаже «Ленты.ру», вообще-то, являются компьютерными моделями. Светочувствительная матрица в специальном приборе (по традиции его продолжают называть «фотоаппаратом») определяет пространственное распределение интенсивности света в нескольких разных спектральных диапазонах, управляющая электроника сохраняет эти данные в цифровом виде, а потом другая электронная схема на основе этих данных отдает команду транзисторам в жидкокристаллическом дисплее. Пленка, бумага, специальные растворы для их обработки — все это стало экзотикой. А если мы вспомним буквальное значение слова, то фотография — это «светопись». Так что говорить о том, что ученым удалось сфотографировать атом, можно лишь с изрядной долей условности.
Больше половины всех астрономических снимков уже давно делают инфракрасные, ультрафиолетовые и рентгеновские телескопы. Электронные микроскопы облучают не светом, а пучком электронов, а атомно-силовые и вовсе сканируют рельеф образца иглой. Есть рентгеновские микроскопы и магнитно-резонансные томографы. Все эти приборы выдают нам точные изображения различных объектов, и несмотря на то что о «светописи» говорить здесь, разумеется, не приходится, мы все же позволим себе именовать такие изображения фотографиями.
Эксперименты физиков по определению формы протона или распределения кварков внутри частиц останутся за кадром; наш рассказ будет ограничен масштабами атомов.
Оптика не стареет
Как выяснилось во второй половине XX века, оптическим микроскопам еще есть куда развиваться. Решающим моментом в биологических и медицинских исследованиях стало появление флуоресцентных красителей и методов, позволяющих избирательно помечать определенные вещества. Это не было «всего лишь новой краской», это был настоящий переворот.
Вопреки расхожему заблуждению, флуоресценция — это вовсе не свечение в темноте (последнее называется люминесценцией). Это явление поглощения квантов определенной энергии (скажем, синего света) с последующим излучением других квантов меньшей энергии и, соответственно, иного света (при поглощении синего испускаться будут зеленые). Если поставить светофильтр, который пропускает только излучаемые красителем кванты и задерживает свет, вызывающий флуоресценцию, можно увидеть темный фон с яркими пятнами красителей, а красители, в свою очередь, могут расцвечивать образец чрезвычайно избирательно.
Например, можно покрасить цитоскелет нервной клетки красным, синапсы выделить зеленым, а ядро — голубым. Можно сделать флуоресцентную метку, которая позволит обнаружить белковые рецепторы на мембране или синтезируемые клеткой в определенных условиях молекулы. Метод иммуногистохимического окрашивания совершил революцию в биологической науке. А когда генные инженеры научились делать трансгенных животных с флуоресцентными белками, этот метод пережил второе рождение: реальностью стали, например, мыши с окрашенными в разные цвета нейронами.
Кроме того, инженеры придумали (и отработали на практике) метод так называемой конфокальной микроскопии. Суть его заключается в том, что микроскоп фокусируется на очень тонкий слой, а специальная диафрагма отсекает создаваемую объектами вне этого слоя засветку. Такой микроскоп может последовательно сканировать образец сверху вниз и получать стопку снимков, которая является готовой основой для трехмерной модели.
Использование лазеров и сложных оптических систем управления лучом позволило решить проблему выгорания красителей и высыхания нежных биологических образцов под ярким светом: луч лазера сканирует образец только тогда, когда это необходимо для съемки. А чтобы не тратить время и силы на осмотр большого препарата через окуляр с узким полем зрения, инженеры предложили автоматическую систему сканирования: на предметный столик современного микроскопа можно положить стекло с образцом, и прибор самостоятельно отснимет масштабную панораму всего образца. При этом в нужных местах он будет наводить на резкость, а затем склеит множество кадров воедино.
В некоторые микроскопы можно посадить живых мышей, крыс или хотя бы мелких беспозвоночных животных. Другие дают небольшое увеличение, зато совмещены с рентгеновским аппаратом. Многие для устранения помех от вибраций монтируются на специальных столах массой в несколько тонн внутри помещений с тщательно контролируемым микроклиматом. Стоимость подобных систем превышает стоимость иных электронных микроскопов, а конкурсы на самый красивый кадр давно стали традицией. Кроме того, продолжается и совершенствование оптики: от поиска лучших сортов стекла и подбора оптимальных комбинаций линз инженеры перешли к способам фокусировки света.
Мы специально перечислили ряд технических подробностей для того, чтобы показать: прогресс в области биологических исследований давно связан с прогрессом в других областях. Если бы не существовало компьютеров, способных автоматически сосчитать число окрашенных клеток на нескольких сотнях фотографий, толку от супермикроскопов было бы немного. А без флуоресцентных красителей все миллионы клеток были бы неотличимы друг от друга, так что проследить за формированием новых или гибелью старых было бы практически невозможно.
По сути, первый микроскоп представлял собой струбцину с закрепленной на ней сферической линзой. Аналогом такого микроскопа может быть простая игральная карта с проделанным в ней отверстием и каплей воды. По некоторым данным подобные устройства применяли золотодобытчики на Колыме уже в прошлом столетии.
За дифракционным пределом
У оптических микроскопов есть принципиальный недостаток. Дело в том, что по форме световых волн невозможно восстановить форму тех предметов, которые оказались намного меньше длины волны: с тем же успехом можно пытаться исследовать тонкую текстуру материала рукой в толстой перчатке для сварочных работ.
Ограничения, создаваемые дифракцией, отчасти удалось преодолеть, причем без нарушения законов физики. Поднырнуть под дифракционный барьер оптическим микроскопам помогают два обстоятельства: то, что при флуоресценции кванты излучаются отдельными молекулами красителя (которые могут довольно далеко отстоять друг от друга), и то, что за счет наложения световых волн можно получить яркое пятно с диаметром, меньшим, чем длина волны.
При наложении друг на друга световые волны способны взаимно друг друга погасить, поэтому параметры освещения образца так, чтобы в яркую область попадал по возможности меньший участок. В сочетании с математическими алгоритмами, которые позволяют, например, убрать двоение изображения, такое направленное освещение дает резкое повышение качества съемки. Становится возможным, к примеру, исследовать в оптический микроскоп внутриклеточные структуры и даже (комбинируя описанный метод с конфокальной микроскопией) получать их трехмерные изображения.
Электронный микроскоп до электронных приборов
Для того чтобы открыть атомы и молекулы, ученым не пришлось их рассматривать — молекулярная теория не нуждалась в том, чтобы видеть объект. А вот микробиология стала возможна только после изобретения микроскопа. Поэтому первое время микроскопы ассоциировались именно с медициной и биологией: физики и химики, изучавшие существенно меньшие объекты, обходились другими средствами. Когда же и им захотелось посмотреть на микромир, дифракционные ограничения стали серьезной проблемой, тем более что описанные выше методы флуоресцентной микроскопии были еще неизвестны. Да и толку от повышения разрешающей способности с 500 до 100 нанометров немного, если объект, который надо рассмотреть, еще меньше!
Зная о том, что электроны могут себя вести и как волна, и как частица, физики из Германии в 1926 году создали электронную линзу. Идея, лежащая в ее основе, была очень простой и понятной любому школьнику: раз электромагнитное поле отклоняет электроны, то с его помощью можно поменять форму пучка этих частиц, растащив их в разные стороны, или, напротив, уменьшить диаметр пучка. Спустя пять лет, в 1931 году Эрнст Руска и Макс Кнолл построили первый в мире электронный микроскоп. В приборе образец сначала просвечивался пучком электронов, а потом электронная линза расширяла прошедший насквозь пучок перед тем, как тот падал на специальный люминесцентный экран. Первый микроскоп давал увеличение всего в 400 раз, но замена света на электроны открыла дорогу к фотографированию с увеличением в сотни тысяч раз: конструкторам пришлось всего лишь преодолеть несколько препятствий технического характера.
Электронный микроскоп позволил рассмотреть устройство клеток в недосягаемом ранее качестве. Но по этому снимку нельзя понять возраст клеток и наличие в них тех или иных белков, а эта информация очень нужна ученым.
Сейчас электронные микроскопы позволяют фотографировать вирусы крупным планом. Существуют разные модификации приборов, позволяющие не только просвечивать тонкие срезы, но и рассматривать их в «отраженном свете» (в отраженных электронах, конечно). Мы не будем подробно рассказывать про все варианты микроскопов, но заметим, что недавно исследователи — они научились восстанавливать изображение по дифракционной картине.
Потрогать, а не рассмотреть
Еще одна революция произошла за счет дальнейшего отхода от принципа «осветить и посмотреть». Атомный силовой микроскоп, равно как и сканирующий туннельный микроскоп, уже ничем на поверхность образцов не светит. Вместо этого по поверхности перемещается особо тонкая игла, которая буквально подпрыгивает даже на неровностях размером с отдельный атом.
Не вдаваясь в детали всех подобных методов, заметим главное: иглу туннельного микроскопа можно не только перемещать вдоль поверхности, но и использовать для перестановки атомов с места на место. Именно таким образом ученые создают надписи, рисунки и даже мультфильмы, в которых нарисованный мальчик играет с атомом. Настоящим атомом ксенона, перетаскиваемым иглой сканирующего туннельного микроскопа.
Туннельным микроскоп называют потому, что он использует эффект протекающего через иглу туннельного тока: электроны проходят через зазор между иглой и поверхностью за счет предсказанного квантовой механикой туннельного эффекта. Для работы такого прибора нужен вакуум.
Намного менее требователен к окружающим условиям атомный силовой микроскоп (АСМ) — он может (с рядом ограничений) работать без откачки воздуха. В определенном смысле АСМ является нанотехнологичным наследником патефона. Игла, закрепленная на тонком и гибком кронштейне-кантилевере (cantilever и есть «кронштейн»), движется вдоль поверхности без подачи на нее напряжения и следует рельефу образца так же, как игла патефона следует вдоль бороздок грампластинки. Изгиб кантилевера заставляет отклоняться закрепленное на нем зеркало, зеркало отклоняет лазерный луч, и это позволяет очень точно определять форму исследуемого образца. Главное только иметь достаточно точную систему перемещения иглы, а также запас игл, которые должны быть идеально острыми. Радиус закругления у кончиков таких игл может не превышать одного нанометра.
АСМ позволяет видеть отдельные атомы и молекулы, однако, как и туннельный микроскоп, не позволяет заглянуть под поверхность образца. Иными словами, ученым приходится выбирать между возможностью видеть атомы и возможностью изучать весь объект целиком. Впрочем, и для оптических микроскопов внутренности изучаемых образцов не всегда доступны, ведь минералы или металлы обычно свет пропускают плохо. Кроме того, с фотографированием атомов все равно возникают сложности — эти объекты предстают простыми шариками, форма электронных облаков на таких снимках не видна.
Синхротронное излучение, возникающее при торможении разогнанных ускорителями заряженных частиц, позволяет изучать окаменевшие останки доисторических животных. Вращая образец под рентгеновскими лучами, мы можем получать трехмерные томограммы — именно так был найден, например, мозг внутри черепа рыб, вымерших 300 миллионов лет назад. Можно обойтись и без вращения, если регистрацию прошедшего излучения фиксацией рассеянных за счет дифракции рентгеновских лучей.
И это еще не все возможности, которые открывает рентгеновское излучение. При облучении им многие материалы флуоресцируют, причем по характеру флуоресценции можно определить химический состав вещества: таким способом ученые окраску древних артефактов, стертые в Средние века труды Архимеда или окраску перьев давно вымерших птиц.
Позируют атомы
На фоне всех тех возможностей, которые предоставляют рентгеновские или оптико-флуоресцентные методы, новый способ фотографирования отдельных атомов уже кажется не таким уж большим прорывом в науке. Суть метода, который позволил получить представленные на этой неделе изображения, такова: с ионизированных атомов срывают электроны и направляют их на специальный детектор. Каждый акт ионизации срывает электрон с определенного положения и дает одну точку на «фотографии». Накопив несколько тысяч таких точек, ученые сформировали картинку, отображающую наиболее вероятные места обнаружения электрона вокруг ядра атома, а это по определению и есть электронное облако.
В заключение скажем, что возможность видеть отдельные атомы с их электронными облаками — это скорее вишенка на торте современной микроскопии. Ученым было важно исследовать структуру материалов, изучать клетки и кристаллы, а обусловленное этим развитие технологий дало возможность дойти до атома водорода. Все, что меньше, — уже сфера интересов специалистов по физике элементарных частиц. А биологам, материаловедам и геологам еще есть куда совершенствовать микроскопы даже с довольно скромным на фоне атомов увеличением. Специалистам по нейрофизиологии, к примеру, давно хочется иметь прибор, способный видеть отдельные клетки внутри живого мозга, а создатели марсоходов продали бы душу за электронный микроскоп, который влезал бы на борт космического аппарата и мог бы работать на Марсе.
Бич конца 20 века, повлекший смерть Freddy Mercury, ежегодно уносящий тысячи людей за черту не возврата в мир живых.
Врага человечества надо знать в , смотрим и запоминаем молекула Вируса СПИДА, он же в научных кругах проходит под псевдонимом ВИЧ.
Вот примерно таким способом клетки делятся на себя подобных.
На картинки момент деления клетки дрожжей.
Любое биологическое существо, неважно человек или растение состоит из генов.
Целой цепочки генов, в принципе от которых многое зависит, из-за недостатка определенных генов человек легко превращается в растение. Обратного процесса пока в природе не наблюдалось.
На картинке Ген растениz Арабидопсис, вот он какой в 3D.
Да наверно любой школьник опознает эту картинку!
Семечко помидора, окруженная крошечными волосками, на ощупь напоминающие слизь. Защищающий семечко от преждевременного высыхания.
Вот она, вожделенная мечта большинства человечества!
За обладанием этого велись долгие и кровопролитные войны, убивали и грабили прохожих в подворотне. На этом замешана вся история человечества.
До сих пор ученые могли только предполагать наличие молекулярных структур. Сегодня же с помощью атомно-силовой микроскопии, отдельные атомные связи (каждая несколько десятков миллионных долей миллиметра длиной), соединяющие молекулу (26 атомов углерода и 14 атомов водорода), можно увидеть довольно четко.
Первоначально, команда хотела работать со структурами из графена, однослойного материала, в котором атомы углерода расположены в виде шестиугольников. Формируя соты углерода, атомы перестраиваются из линейной цепи в шестигранники; эта реакция может давать несколько различных молекул.
Феликс Фишер, химик Калифорнийского университет в Беркли, и его коллеги хотели визуализировать молекулы, чтобы убедиться, что все сделали правильно.
Кольчатая, углеродсодержащая молекула, показанная до и после реорганизации с двумя наиболее распространенными продуктами реакции, проходившей при температуре выше 90 градусов Цельсия. Размер: 3 ангстрема или трех-десяти миллиардная доля метра в поперечнике.
Чтобы задокументировать рецепт графена, Фишеру было необходимо мощное устройство обработки изображений, и он обратился к атомно-силовому микроскопу, который был у Майкла Кромми из лаборатории Калифорнийского университета.
Бесконтактная атомно-силовая микроскопия (NC-AFM) использует очень тонкий и чувствительный датчик, чтобы почувствовать электрическую силу, создаваемую молекулами. Кончик перемещается вблизи поверхности молекулы, испытывая отклонения разными зарядами, создавая образ того, как перемещаются атомы.
Одноатомный кончик бесконтактного атомно-силового микроскопа «прощупывает» поверхность с помощью острой иглы. Игла движется по поверхности исследуемого объекта подобно тому, как игла фонографа проходит по желобкам пластинки. Кроме атомов, возможно «прощупывать» и атомные связи
Так команде удалось не только визуализировать атомы углерода, но и связи между ними, созданные общими электронами. Они поместили кольчатые структуры углерода на серебренную пластину и нагрели ее, чтобы реорганизовать молекулу. Охлажденные продукты реакции, содержали три неожиданных продукта и только одну молекулу, ожидаемую учеными.
Предлагаем оценить снимки финалистов, претендующих на звание« Фотограф года» Королевского фотографического общества. Победителя объявят уже 7 октября, а выставка лучших работ пройдет с 7 октября по 5 января в Музее науки в Лондоне.
Редакция ПМ
«Структура мыльного пузыря», автор Ким Кокс
Мыльные пузыри оптимизируют пространство внутри себя и минимизируют площадь их поверхности для заданного объема воздуха. Это делает их полезным объектом исследования во многих областях, в частности, в области материаловедения. Стенки пузырьков как бы стекают под действием силы тяжести: они тонкие вверху и толстые внизу.
«Разметка на молекулах кислорода», Ясмин Кроуфорд
Снимок входит в последний крупный проект автора в рамках магистерской работе по фотографии в университете Фалмута, где основное внимание уделялось исследованию миалгического энцефаломиелита. Кроуфорд говорит, что создает образы, которые связывают нас с неоднозначным и неизвестным.
«Спокойствие вечности», автор Евгений Самученко
Снимок сделан в Гималаях на озере Госаикунда на высоте 4400 метров. Млечный Путь — это галактика, в которую входит и наша Солнечная система: смутная полоса света на ночном небе.
«Смущенный мучной жук», автор Дэвид Спирс
Этот маленький жук-вредитель заводится зерновых и мучных изделиях. Изображение было получено с помощью сканирующей электронной микрофотографии, а затем окрашено в Photoshop.
«Туманность «Северная Америка», Дэйв Уотсон
Туманность «Северная Америка» NGC7000 — это эмиссионная туманность в созвездии Лебедя. Форма туманности напоминает форму Северной Америки — можно увидеть даже Мексиканский залив.
«Жук-олень», автор Виктор Сикора
Фотограф использовал световую микроскопию с увеличением в пять раз.
«Телескоп Ловелла», автор Мардж Брэдшоу
«Я была очарована телескопом Ловелла в Джодрелл Бэнк с тех пор, как увидела ее на школьной экскурсии», — говорит Брэдшоу. Она хотела сделать несколько более детальных фотографий, чтобы показать его износ.
«Медузы вверх ногами», автор Мэри Энн Чилтон
Вместо того, чтобы плавать, этот вид проводит время, пульсируя в воде. Цвет медуз — результат поедания водорослей.
В молекуле воды главным действующим лицом является атом кислорода.
Поскольку атомы водорода друг от друга заметно отталкиваются, угол между химическими связями (линиями, соединяющими ядра атомов) водород — кислород не прямой (90°), а немного больше — 104,5°.
Химические связи в молекуле воды – полярные, так как кислород подтягивает к себе отрицательно заряженные электроны, а водород — положительно заряженные электроны. В результате вблизи атома кислорода скапливается избыточный отрицательный заряд, а у атомов водорода — положительный.
Поэтому вся молекула воды является диполем, то есть молекулой с двумя разноименными полюсами. Дипольная структура молекулы воды во многом определяет ее необычные свойства.
Молекула воды – это диамагнетик.
Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура — тетраэдр. Таково строение самой молекулы воды.
При изменении состояния молекулы воды длина сторон и угол между ними изменяются в тетраэдре.
Например, если молекула воды находится в парообразном состоянии, то угол, образованный ее сторонами, равняется 104°27″. В водном состоянии угол составляет 105°03″. И в состоянии льда угол равен 109,5°.
Геометрия и размеры молекулы воды для различных состояний
а — для парообразного состояния
б — для низшего колебательного уровня
в — для уровня, близкого к образованию кристалла льда, когда геометрия молекулы воды соответствует геометрии двух египетских треугольников с соотношением сторон 3: 4: 5
г — для состояния льда.
Если разделить пополам эти углы, то получим углы:
104°27″: 2 = 52°13″,
105°03″: 2 = 52°31″,
106°16″: 2 = 53°08″,
109,5°: 2 = 54°32″.
Значит, среди геометрических рисунков молекулы воды и льда находится знаменитый египетский треугольник, в основу построения которого заложены соотношения золотой пропорции — длины сторон относятся как 3:4:5 с углом 53°08″.
Молекула воды приобретает строение золотой пропорции на пути, когда вода переходит в лед, и наоборот, когда лед тает. Очевидно, за это состояние и ценится талая вода, когда ее структура в построении имеет пропорции золотого сечения.
Теперь становится понятным, что знаменитый египетский треугольник с соотношением сторон 3:4:5 «взят» из одного из состояний молекулы воды. Сама же геометрия молекулы воды образована двумя египетскими прямоугольными треугольниками, имеющими общий катет равный 3.
Молекула воды, имеющая в основе соотношение золотой пропорции, является физическим проявлением Божественной Природы, которая участвует в создании жизнь. Именно поэтому в земной природе заложена та гармония, которая присуща всему космосу.
И поэтому древние египтяне обожествляли числа 3, 4, 5, а сам треугольник считали священным и старались заложить его свойства, его гармонию в любую конструкцию, дома, пирамиды и даже в разметку полей. Кстати, украинские хаты строились тоже с применением соотношения золотой пропорции.
В пространстве молекула воды занимает некоторый объем, и покрыта электронной оболочкой в виде вуали. Если представить вид гипотетической модели молекулы в плоскости, то она похожа на крылья бабочки, на Х-образную хромосому, в которой записана программа жизни живого существа. И это является показательным фактом того, что сама вода — это обязательный элемент всего живого.
Если представить вид гипотетической модели молекулы воды в объеме, то она передает форму треугольной пирамиды, у которой имеется 4 грани, а у каждой грани по 3 ребра. В геометрии треугольная пирамида называется тетраэдром. Такое строение свойственно кристаллам.
Таким образом, молекула воды образует прочную уголковую структуру, которую она сохраняет даже, когда находится в парообразном состоянии, на грани перехода в лед, и когда превращается в лед.
Если «скелет» молекулы воды так устойчив, то и его энергетическая «пирамида» — тетраэдр тоже стоит непоколебимо.
Такие структурные свойства молекулы воды в различных условиях объясняются прочными связями между двумя атомами водорода и одним атомом кислорода. Эта связь примерно в 25 раз сильнее, чем связь между соседними молекулами воды. Поэтому легче отделить одну молекулу воды от другой, например, при нагревании, чем разрушить саму молекулу воды.
За счет ориентационных, индукционных, дисперсионных взаимодействий (сил Ван-дер-Ваальса) и водородных связей между атомами водорода и кислорода соседних молекул молекулы воды способны образовывать как случайные ассоциаты, т.е. не имеющие упорядоченной структуры, так и кластеры – ассоциаты, имеющие определенную структуру.
Согласно статистическим данным, в обычной воде находится случайных ассоциатов — 60% (деструктурированная вода) и кластеров — 40% (структурированная вода).
В результате исследований, проведенных российским ученым С. В. Зениным, были обнаружены стабильные долгоживущие кластеры воды.
Зенин установил, что молекулы воды первоначально образуют додекаэдр. Четыре додекаэдра соединяясь, образует основной структурный элемент воды — кластер, состоящий из 57 молекул воды.
В кластере додекаэдры имеют общие грани, а их центры образуют правильный тетраэдр. Это объёмное соединение молекул воды, в том числе гексамеров, которое имеет положительные и отрицательные полюса.
Водородные мостики позволяют молекулам воды объединяться самыми различными способами. Благодаря этому в воде наблюдается бесконечное разнообразие кластеров.
Кластеры могут взаимодействовать друг с другом за счет свободных водородных связей, что приводит к появлению структур второго порядка в виде шестигранников. Они состоят из 912 молекул воды, которые практически не способны к взаимодействию. Время существования такой структуры весьма велико.
Эту структуру, похожую на маленький острый кристаллик льда из 6 ромбических граней, С.В. Зенин назвал «основным структурным элементом воды”. Многочисленные эксперименты подтвердили; в воде — мириады таких кристалликов.
Эти кристаллики льда почти не взаимодействуют друг с другом, поэтому не образуют более сложных устойчивых конструкций и легко скользят гранями относительно друг друга, создавая текучесть. В этом смысле вода напоминает переохлажденный раствор, который никак не может кристаллизоваться.
в чем суть, примеры материалов, цветов и форм
Возможно вы думали, что изображения химических соединений остались в школьном прошлом и забыты навсегда, однако дизайнеры нашли вдохновение и в этом хаотичном сплетении частиц, перенеся его в облик источников света — люстра-молекула — новый хит в освещении пространства.
История создания
Современные стили интерьеров отличаются оригинальными идеями в деталях. Для создания новых образов дизайнеры постоянно ищут источники вдохновения, а потому идейный аспект создания предмета интерьера это то, что удивляет больше, чем сам продукт. Найдя источник оригинальности в молекулярных соединениях, были созданы предметы мягкой мебели, имитирующие процесс мутации клеток, зеркала, напоминающие растекшийся металл, столы с основанием в виде молекулярной модели или структуры ДНК.
Мягкая мебель коллекции Mutation Series дизайнера Мартина Де Кюлуаэр
Дизайнеры Анна Мария Миди и Джордж Альманда выпустили под своим брендом Casamidy журнальный столик, основание которого имитирует сложную полимерную сетку
Производители источников света не остались в стороне от молекулярной моды. Светильники и люстры, выполняя функцию освещения, нередко являются центральными акцентами в комнате. Создание функционального украшения пространства стало перспективным и одним из популярных направлений дизайнерской мысли.
Воплощение структур организации молекулярных частиц отличается разнообразием, а потому является неисчерпаемым источником вдохновения.
Люстра молекула фото:
Светильник-атом — воплощение изящества природных частиц
Люстра в виде молекулы в черном цвете — необычный акцент комнаты
Материалы светильников
Количество видов современных материалов для производства светильников практически безгранично. В зависимости от того, какую стилистику интерьера поддерживает предмет освещения, их изготовление возможно из металла, стекла или пластика.
Обязательным элементом такого вида изделия является стеклянные шарообразные плафоны, которые могут быть как матовыми, так и прозрачными.
Примеры оформления плафонов в светильниках-молекулах
Соединения между плафонами, имитирующими атомы в молекулярной формуле, могут оформлены из металлических массивных соединений, изящных прямых линий или едва заметных гибких оснований.
Из кованого металла изготавливаются светильники молекулы в стиле лофт. Их внешний вид напоминает схему движения атомных частиц вокруг центрального источника света.
Кованые элементы светильников-атомов имитируют движение частиц
В природном эко интерьере отдельные детали светильников могут быть изготовлены из дерева.
Упорядоченные соединения атомов в деревянном исполнении
Разнообразие молекулярных моделей
В природе встречается огромное разнообразие молекул, а потому и количество структурированных образов воплощения этих частиц безгранично.
Формы
- Подобие атомного хаоса
У светильников такой формы нет четкой геометрии расположения осей и плафонов. Визуально такие изделия, имитирующие броуновское движение, изготавливаются из металла и отличаются оригинальностью образа.
Некоторые светильники имеют столько масштабное воплощение, что их смело можно отнести к произведениям современного искусства.
Такое изделие отлично смотрится на технологичной кухне или центре ультрасовременной гостиной.
Люстры атомы созданы не столько для освещения пространства, сколько для эпатажного акцента интерьера
- Упорядоченная кристаллическая решетка атомов и молекул твердых тел передана с помощью строгой простой геометрии.
Светильники такого вида представляют из себя структурированные соединения источников света, в которых прослеживается объем и определенный порядок.
Они более консервативны по форме, но отнюдь не банальны в оформлении.
Такие люстры-молекулы украшают потолок станции метро “Менделеевская” в Москве
Пример потолочного светильника-атома кристаллической решетки
Замысловатое переплетение световых плафонов вокруг оси создает самую узнаваемую форму молекулы.
ДНК-светильник большого размера уместно разместить в обеденной зоне или возле лестницы в холле.
Масштабная имитация молекулы ДНК в образе люстр
- Скученные формы
Футуристические светильники такого вида напоминают собой молекулы различных веществ. Гроздья свисающих с потолка частиц наиболее удачно они будут смотреться в интерьере стиля хай-тек или неоклассики.
СОВЕТ! Поддержите облик необычной люстры с помощью бра-молекул. Этот ход поможет интерьеру приобрести более логичный и продуманный вид.
Такая люстра напоминает молекулу воды за счет своего цвета
Люстра-имитация взрыва атомов и молекул
Цветовая гамма
Внешний вид люстр молекул настолько эксклюзивный, что броское цветовое решение здесь будет явным перебором.
Светильники такого ряда отличаются монохромностью исполнения с небольшими цветовыми нюансами.
Металлические основания могут быть в золотом, серебряном, бронзовом, черном или белом цветах. Подвесы, как правило, оснащены едва заметными нитями-держателями.
Цвет плафонов не отличается слишком большим разнообразием: матовое белое стекло, прозрачное с легким оттенком серого, голубого, розового, перламутрового, черные и голографические цвета в футуристических формах.
Примеры цвета в люстрах-молекулах
Размеры
Современный рынок осветительных приборов предлагает неисчерпаемое многообразие не только форм изделий, но и их размеров.
Выбирая светильник молекулу в комнату правильно оцените размеры помещения и высоту потолков.
Горизонтальные люстры имеют большую площадь освещения, а потому идеально подходят для расположения над обеденным столом.
При достаточных размерах помещения установка двух потолочных светильников молекул выглядит роскошно
СОВЕТ! Небольшая высота конструкции светильника не означает его безусловно уместное расположение в помещениях с низким потолком. Остановите свой выбор на приборах с небольшим количеством и густотой плафонов. Однорядные модели будут идеальным решением в такой ситуации.
Высокие люстры молекулы в интерьере или светильники объемом более полуметра гармонично смотрятся в просторных домах.
Подбирая центральное освещение важно помнить о том, что нижняя точка источника света должна располагаться на такой высоте, чтобы жильцы не касались её даже вытянутыми вверх руками. Этот параметр возможно нарушить только в случае размещения светильника над столом или иной функциональной зоной, когда точкой отсчета будет являться поверхность, а не человеческий рост. Подробный обзор о схемах и правилах размещения светильников сделали специалисты светодизайна.
В каких интерьерах уместна люстра молекула
Гармоничное расположение светильника в определенном стиле зависит от нюансов его оформления.
Люстры потолочные молекулы с коваными круговыми элементами в виде осей пересечений подходят для индустриального стиля.
Сочетание в светильнике кованых элементов, имитирующих движение атомов вокруг источника света, и хрусталя в обрамлении свеч
Так как в стиле хай-тек поощряются только единичные акценты в обустройстве пространства, футуристические молекулярные формы могут внести в лаконичный интерьер интересные детали.
Технологичный интерьер с люстрой-молекулой
Сдержанные варианты упорядоченных молекулярных решеток можно смело применять в современной эклектике или арт-деко. Поддержать необычную люстру можно бра-молекулами.
Обратите внимание на богатый выбор светильников Maytoni атомы:
Разнообразие моделей потолочных светильников атомов Maytoni
Вечную классику можно разбавить актуальными потолочными моделями-имитациями атомов и настольной лампой-молекулой.
Изящное украшение вашего рабочего места или прикроватной тумбочки — настольная лампа-молекула
Оригинальность светового оформления пространства может стать интересной деталью вашего дома и подчеркнет нетривиальный вкус хозяина. Великое разнообразие люстр-молекул позволит сделать интерьер оригинальным даже при достаточной популярности такого дизайнерского решения.
Первые в истории изображения молекулы с высоким разрешением, когда она разрывает и восстанавливает химические связи
Это изображение, сделанное с помощью бесконтактного атомно-силового микроскопа, почти так же четко, как и диаграмма из учебника, показывает положения отдельных атомов и связей в молекуле, имеющей 26 атомов углерода и 14 атомов водорода, структурированных как три соединенных бензольных кольца. Предоставлено: Национальная лаборатория Лоуренса Беркли и Калифорнийский университет в Беркли.Когда Феликс Фишер из U.Национальная лаборатория им. Лоуренса в Беркли (Лаборатория Беркли) Министерства энергетики США приступила к разработке наноструктур из графена с использованием нового контролируемого подхода к химическим реакциям. Первый результат был неожиданным: впечатляющие изображения отдельных атомов углерода и связей между ними.
«Мы не думали о создании красивых изображений; целью были сами реакции», — говорит Фишер, научный сотрудник отделения материаловедения лаборатории Беркли (MSD) и профессор химии Калифорнийского университета в Беркли.«Но чтобы действительно увидеть, что происходит на уровне одного атома, нам пришлось использовать уникально чувствительный атомно-силовой микроскоп в лаборатории Майкла Кромми». Кромми — ученый-магистр наук и профессор физики Калифорнийского университета в Беркли.
То, что микроскоп показал исследователям, по словам Фишера, «было потрясающе». Конкретные результаты реакции сами по себе были неожиданными, но визуальные свидетельства были еще более неожиданными. «Никто никогда не делал прямых изображений отдельных молекул с разрешением одинарной связи, непосредственно до и сразу после сложной органической реакции», — говорит Фишер.
Исследователи сообщают о своих результатах в выпуске журнала Science от 7 июня 2013 г., который заранее доступен на сайте Science Express .
Графеновые наноструктуры снизу вверх
Графеновые наноструктуры могут формировать транзисторы, логические вентили и другие элементы изысканно крошечных электронных устройств, но для того, чтобы они стали практичными, их нужно будет производить массово с атомной точностью. Нисходящие методы сверху вниз, такие как отшелушивание графита или распаковка углеродных нанотрубок, не справятся с этой задачей.
Фишер и его коллеги приступили к проектированию графеновых наноструктур снизу вверх, преобразовывая линейные цепочки атомов углерода в протяженные гексагональные листы (полиароматические углеводороды), используя реакцию, первоначально открытую профессором Калифорнийского университета в Беркли Робертом Бергманом. Первым требованием было проведение реакций в контролируемых условиях.
Исходная молекула реагента, покоящаяся на плоской серебряной поверхности, отображается как до, так и после реакции, которая происходит, когда температура превышает 90 градусов Цельсия.Показаны два наиболее распространенных конечных продукта реакции. Шкала в три ангстрема (ангстрем — это десятимиллиардная часть метра) показывает, что молекулы реагента и продукта имеют размер примерно в миллиардную долю метра. Предоставлено: Национальная лаборатория Лоуренса Беркли и Калифорнийский университет в Беркли.«В растворе более дюжины соединений могут быть продуктами реакции, которую мы использовали, и охарактеризовать результаты будет сложно», — говорит Фишер. «Вместо 3D-решения мы создали 2D-систему.Мы помещаем нашу исходную молекулу — структуру, называемую олиго-ендиин, состоящую из трех бензольных колец, связанных атомами углерода, — на поверхность серебра, а затем вызываем реакции, нагревая ее ».
Группа Фишера в сотрудничестве с экспертом по микроскопии Кромми разработала наилучшее изображение. Первая попытка проследить реакции использовалась с помощью сканирующего туннельного микроскопа (СТМ), который определяет электронные состояния, когда они помещаются в пределах нескольких миллиардных долей метра (нанометров) от поверхности образца.Но разрешение изображения крошечной молекулы и ее продуктов — каждое всего около одного нанометра в поперечнике — было недостаточно для надежной идентификации молекулярных структур.
Затем сотрудники обратились к технике, называемой бесконтактной атомно-силовой микроскопией (nc-AFM), которая исследует поверхность острым концом. Наконечник механически отклоняется электронными силами очень близко к образцу, перемещаясь, как игла фонографа в канавке.
«Молекула окиси углерода, адсорбированная на кончике« иглы »АСМ, оставляет единственный атом кислорода в качестве зонда», — объясняет Фишер.«Перемещение этого« атомного пальца »вперед и назад по серебряной поверхности похоже на чтение шрифта Брайля, как если бы мы ощущали небольшие удары атомного масштаба, создаваемые атомами». Фишер отмечает, что формирование изображений с помощью АСМ высокого разрешения было впервые выполнено группой Герхарда Мейера в IBM Zurich, «но здесь мы используем его, чтобы понять результаты фундаментальной химической реакции».
Одноатомное острие бесконтактного атомно-силового микроскопа «чувствует» изменения силы электронных сил, когда оно движется по поверхности на постоянной высоте.Результирующие движения стилуса обнаруживаются лазерным лучом для вычисления изображений. Предоставлено: Национальная лаборатория Лоуренса Беркли и Калифорнийский университет в Беркли.Одноатомный движущийся палец нк-АСМ мог чувствовать не только отдельные атомы, но и силы, представляющие связи, образованные электронами, разделенными между ними. Полученные изображения поразительно напоминали диаграммы из учебника или на доске, используемой для преподавания химии, за исключением того, что здесь не требуется воображение.
Фишер говорит: «То, что вы видите, — это то, что вы имеете — эффекты электронных сил между атомами и даже порядок связей. Вы можете различать одинарные, двойные и тройные связи».
Однако понятие химической связи не так просто, как может показаться. Из множества возможных вариантов реакция исходной молекулы не привела к тому, что интуитивно казалось Фишеру и его коллегам наиболее вероятными продуктами. Вместо этого в результате реакции образовались две разные молекулы. Плоская серебряная поверхность делала реакцию видимой, но также неожиданно формировала ее.
Микроскопия nc-AFM дала поразительное визуальное подтверждение механизмов, лежащих в основе этих синтетических органических химических реакций, а неожиданные результаты подтвердили перспективность этого мощного нового метода создания продвинутых наноразмерных электронных устройств снизу вверх.
Прежде чем в результате этого уникального подхода появятся гораздо более сложные графитовые наноструктуры, говорит Фишер, «впереди нас ждут большие открытия».
Впервые в мире атомно-силовой микроскоп видит химические связи в отдельных молекулах (с видео)
Дополнительная информация: «Прямая визуализация структуры ковалентных связей в химических реакциях одиночных молекул», Димас Г.де Отейза и др. Science Express , 2013 г. Предоставлено Национальная лаборатория Лоуренса Беркли
Ссылка : Первые в истории изображения молекулы с высоким разрешением, когда она разрывает и восстанавливает химические связи (30 мая 2013 г.) получено 28 октября 2021 г. с https: // физ.org / news / 2013-05-первые-изображения-молекулы-реформы с высоким разрешением .html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
атомов, молекул и соединений | Маноа.hawaii.edu/ExploringOurFluidEarth
Химические структуры
Свойства элементов и соединений определяются их структурой. Простейшей структурной единицей элемента является атом. Атомы очень маленькие. Сто миллионов (100000000) атомов водорода, поставленных рядом, имеют длину всего один сантиметр!
Некоторые элементы являются одноатомными , что означает, что они состоят из одного ( mon- ) атома ( -атомное ) в их молекулярной форме.Гелий (He, см. Рис. 2.8) является примером одноатомного элемента. Другие элементы содержат два или более атомов в своей молекулярной форме (рис. 2.8). Молекулы водорода (H 2 ), кислорода (O 2 ) и хлора (Cl 2 ), например, содержат по два атома каждая. Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
Молекулы соединений содержат атомы двух или более различных элементов.Например, вода (H 2 O) имеет три атома, два атома водорода (H) и один атом кислорода (O). Метан (CH 4 ), обычный парниковый газ, состоит из пяти атомов: одного углерода (C) и четырех атомов водорода (H, см. Рис. 2.9).
Электростатические силы
Электростатические силы удерживают атомы в молекулах. Электростатические силы, удерживающие атомы вместе в молекулах, представляют собой силы того же типа, которые вызывают статическое электричество.Распространенные примеры статического электричества — это когда кто-то получает электрический ток, когда тянется к дверной ручке, или когда волосы ребенка вздымаются, когда он спускается с пластиковой горки (рис. 2.10).
Деятельность
Определите, как взаимодействует заряженная материя.
Части атомов
Частицы, составляющие атом, называются субатомными частицами ( sub — означает «меньший размер»). Эти частицы —
- протон (p + ), который заряжен положительно (+);
- электрон (е — ), который отрицательно (-) заряжен; и
- нейтрон (n 0 ), у которого нет заряда, он нейтрален (0).
Протоны и нейтроны занимают ядро , или центр атома. Электроны существуют в областях, называемых оболочками вне ядра атома (рис. 2.11).
Электростатические силы удерживают атомы вместе в молекулах — как два атома водорода, удерживаемые вместе в газе h3. Электростатические силы также удерживают электроны и протоны вместе в атоме. Притяжение между отрицательно заряженными электронами и положительно заряженными протонами в атоме придает атому его структуру.Сильная сила удерживает нейтроны и протоны вместе в ядре. Эта сила получила свое название, потому что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов. Количество электронов и протонов в атоме определяет его химические свойства. Химические свойства включают особые способы реакции атомов и молекул, а также энергию, которую они выделяют или используют в этих реакциях.
Размер субатомных частиц
Сто миллионов (100 000 000) атомов водорода, поставленных рядом, равняются примерно сантиметру.Протоны и нейтроны имеют примерно одну тысячную (1/1000) диаметра атома водорода. Это означает, что потребуется около ста миллиардов (100000000000) протонов или нейтронов, поставленных рядом, чтобы равняться сантиметру. Электроны составляют примерно одну тысячную (1/1000) диаметра протона или нейтрона. Это означает, что потребуется сто триллионов (100 000 000 000 000) электронов, поставленных бок о бок, чтобы равняться сантиметру!
Нейтральные атомы
Субатомные частицы в атоме определяют свойства атома.Некоторые атомы существуют в природе как нейтральные или незаряженные атомы. Один незаряженный атом имеет равное количество протонов (+) и электронов (-). Незаряженный атом электрически нейтрален, потому что электроны и протоны имеют противоположные заряды равных размеров. Когда количество протонов и электронов в атоме одинаково, заряды компенсируются или противодействуют друг другу.
Протоны и нейтроны
Каждый атом определенного элемента имеет одинаковое количество протонов. Атомный номер равен количеству протонов в элементе.В периодической таблице атомный номер обычно указывается как целое число над символом элемента (см. Рис. 2.13). Например, водород (H) имеет атомный номер один (1). Это означает, что у атома водорода есть один протон. Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что у нейтрального атома кислорода восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89, поэтому у него 89 протонов и 89 электронов в нейтральном атоме.Таблица 2.2 показывает атомный номер, атомный символ, атомную структуру и количество протонов, нейтронов и электронов для первых трех элементов.
| Водород | Гелий | Литий | |
| Атомный номер | 1 | 2 | 3 |
| Атомный символ | H | He | Li |
| Число протонов | 1 | 2 | 3 |
| Число электронов | 1 | 2 | 3 |
| Количество нейтронов | 0 | 2 | 4 |
| Атомная структура |
Нейтроны влияют на массу атома и играют роль в стабильности атомов.В отличие от протонов, количество нейтронов в элементах разное. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. У большинства атомов гелия есть два нейтрона, но у некоторых есть три нейтрона.
Периоды, группы и периодическая таблица
Периодическая таблица (рис. 2.12) — широко используемый метод организации элементов, который предоставляет полезную информацию об элементах и их поведении.На рис. 2.12 элементы синего цвета — это металлы, а элементы желтого — неметаллы. На рис. 2.13 запись для водорода показывает расположение атомного номера, символа элемента, имени элемента и атомного веса.
Периодическая таблица Менделеева имеет три характерные особенности. Во-первых, таблица Менделеева выстроена в горизонтальные ряды, которые называются периодами и . Есть семь периодов. В периоде 1 есть два элемента: водород (H) и гелий (He).Второй и третий периоды содержат восемь элементов, четвертый и пятый периоды содержат 18 элементов, а шестой и седьмой периоды содержат 32 элемента.
Во-вторых, все элементы перечислены последовательно в соответствии с их атомными номерами. Атомный номер соответствует количеству протонов и находится над символом элемента. Например, на рисунке 2.13 атомный номер водорода равен 1, что соответствует H.
.В-третьих, периодическая таблица состоит из столбцов элементов, которые реагируют одинаково.Эти столбцы называются группами . Номер группы находится вверху столбца. Группы 1–12 содержат только металлы, группы 13–16 содержат как металлы, так и неметаллы, а группы 17 и 18 содержат только неметаллы. Единственное исключение — водород. Хотя технически это неметалл, водород обладает свойствами как металлов, так и неметаллов, и его часто помещают в группу 1. Две длинные строки в нижней части периодической таблицы являются исключением. Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами.Эти две группы расположены в ряды, а не столбцы.
Металлы и неметаллы
Металлы — это элементы, проводящие тепло и электричество. Металлы обычно ковкие, их можно гнуть или формовать без разрушения, а — блестящие, или блестящие. Большинство металлов имеют серебристый цвет (рис. 2.14 A – C), хотя некоторые не имеют, как медь (Cu, рис. 2.14 D). Большинство металлов твердые при комнатной температуре. Единственным исключением является ртуть (Hg), которая при комнатной температуре является жидкостью (рис.2.14 А). Элементы группы 1, включая литий (Li), натрий (Na, рис. 2.14 B), калий (K, рис. 2.14 C) и рубидий (Rb), являются металлами. Эти металлические элементы Группы 1 обладают аналогичными реакционными свойствами. На рис. 2.12 металлы показаны синим цветом.
Неметаллы плохо проводят тепло и электричество; они не блестящие и существуют в природе в виде твердых тел, жидкостей или газов. В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например сера, которая расслаивается, а не изгибается, как металл (рис.2,15 А). Элементы в группе 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 B), бром (Br 2 , рис. 2.15 C) и йод (I 2 , рис. 2.15 D), все неметаллы. Неметаллы в Группе 17 все двухатомные (два атома) в своей элементарной форме и имеют аналогичные реакционные свойства. На рис. 2.12 неметаллы показаны желтым цветом.
См. Таблицу 2.3, где представлена сводная информация о свойствах металлов и неметаллов.
| Металлы | Неметаллы | |
| Физические свойства | Хороший проводник тепла и электричества | Плохой проводник тепла и электричества |
| Ковкий — можно бить или деформировать без образования трещин; податливый | Хрупкий | |
| Дуктильный — может быть превращен в проволоку | Непластичный | |
| Блестящий | Бесцветный, может быть непрозрачным или прозрачным | |
| Твердое вещество при комнатной температуре (кроме Hg и некоторых других металлов, находящихся в жидком состоянии при комнатной температуре или близкой к ней) | Твердое, жидкое или газообразное при комнатной температуре | |
| Химические свойства | Обычно имеют 1-3 валентных электрона | Обычно имеют 4-8 валентных электронов |
| Имеют тенденцию терять валентные электроны | Накапливают электроны |
Другие организационные особенности Периодической таблицы
Есть и другие организационные особенности таблицы Менделеева.Большинство периодов имеют первый элемент периода в группе 1 и последний элемент в группе 18. Исключением является первый период. На рис. 2.12 водород (H) находится в группе 1. Иногда водород (H) помещается в группу 17, выше фтора (F), потому что он имеет свойства, аналогичные неметаллам в этой группе; например, в элементарном состоянии водород существует в виде двухатомного газа h3. Иногда водород помещают в группы 1 и 17.
Группы элементов имеют похожие свойства.Свойства некоторых групп настолько уникальны или важны, что группы называются специальными именами. Последняя группа, группа 18, включает гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Элементы этой группы называются благородными газами. Благородные газы редко вступают в реакцию с другими элементами. Благородные газы имеют множество применений, например, они используются в неоновых вывесках (рис. 2.16).
Группа 1 часто называется щелочными металлами, группа 2 — щелочноземельными металлами, а группа 17 — галогенами.Две группы, расположенные в нижней части таблицы Менделеева в строках, называются серией редкоземельных элементов лантаноидов (верхняя строка) и серией актинидов (нижняя строка).
У нас есть первые изображения молекул, меняющих свой заряд
Используя одни из самых передовых микроскопов в мире, ученые получили изображения молекул, меняющих свой заряд в реальном времени. Для этого они добавляли и удаляли электроны, непосредственно наблюдая за изменениями структуры четырех молекул.
Хотя мы давно знаем, что такие изменения происходят, это первый раз, когда кто-то действительно видел, как это происходит. Это могло бы помочь нам получить новое понимание нескольких молекулярных процессов, включая химические реакции, катализ и перенос заряда, и, возможно, даже процессы в живых организмах.
«Мы смогли с беспрецедентным разрешением разрешить структурные изменения отдельных молекул при зарядке», — пояснил химик Лео Гросс из IBM Research-Zurich.
«Это новое понимание открывает некоторые загадки молекулярных отношений заряда и функции, связанных с тем, как биология преобразовывает и переносит энергию».
Справа вы можете видеть формы молекул в ложном цвете. (IBM)
Команда использовала атомно-силовую микроскопию, которая состоит из зонда с очень острым концом на свободном конце кантилевера. Зонд опускается к поверхности и отклоняется от нее снова и снова.
При этом лазер обнаруживает небольшие изменения в отклонениях кантилевера, когда он перемещается по рельефным поверхностям.Они записываются для создания изображения того, что сканирует зонд. Таким образом, ученые могут отображать объекты, которые слишком малы, чтобы их можно было увидеть оптическими средствами.
Итак, четыре типа молекул — азобензол, пентацен, тетрацианохинодиметан (TCNQ) и порфин — были помещены под микроскоп в холодной вакуумной камере, чтобы гарантировать, что никакие внешние воздействия не повлияют на результаты.
Одиночную молекулу помещали на пленку хлорида натрия, а затем через зонд пропускали небольшое напряжение для передачи электронов молекуле по одному.
Гросс и его коллеги уже разработали эту технику для контроля заряда и описали ее в статье в 2015 году. И они описали свою технику визуализации в 2009 году.
Однако в этой новой работе команда нашла способ объединить два метода визуализации молекул и одновременного контроля заряда.
Они представили все четыре молекулы в двух или более из этих четырех состояний: положительном (минус один электрон), нейтральном (такое же количество протонов и электронов), отрицательном (плюс один электрон) и дважды отрицательном (плюс два электрона).Все четыре молекулы по-разному реагировали на изменение заряда.
На видео ниже вы можете своими глазами увидеть, как молекула порфина трансформируется в форму, когда она приобретает электроны в этих контролируемых условиях.
Молекула азобензола физически закручена. С пентаценом области молекулы стали более реактивными из-за дополнительных электронов. Изменение заряда привело к изменению типа связей между атомами TCNQ, и он физически перемещался по пленке.А в порфине изменился не только тип связей, но и их длина.
Помимо того, что на эти открытия действительно интересно смотреть, они могут серьезно повлиять на наше нынешнее понимание молекулярной передачи энергии.
В частности, пристальный взгляд на молекулы порфина может помочь нам лучше понять некоторые фундаментальные биологические процессы, поскольку порфин является исходным соединением порфиринов, группы органических соединений, составляющих как хлорофилл, так и гемоглобин.
«Переход заряда этих молекул необходим для жизни», — сказал Гросс.
«С нашей новой техникой мы можем лучше понять, как заряд изменяет структуру и функции молекул, которые жизненно важны во многих отношениях, например, для фотопреобразования и переноса энергии в живых организмах».
Исследование опубликовано в журнале Science .
Исследователи впервые сделали фотографии молекул, образующих химические связи
Ученые-ботаники и фотографы могут сегодня взяться за руки и с трепетом смотреть на то, что удалось сделать группе исследователей из Национальной лаборатории им. Лоуренса Беркли Министерства энергетики США.Совершенно случайно этим ученым удалось сделать первые в мире изображения атомов углерода в процессе образования химических связей в высоком разрешении.
Команда, возглавляемая Феликсом Фишером, на самом деле пыталась создать крошечные наноструктуры из графена — по сути, слой вещества графита толщиной в одну молекулу, который может революционизировать все, от схем до сенсорных экранов. Но создание правильных графеновых наноструктур — сложный процесс, поэтому Фишер попросил позаимствовать атомный силовой микроскоп Майкла Кромми, физика из Беркли, который мог бы захватывать атомные изображения молекул, падающих на место.
Хотя первоначальный эксперимент провалился, полученные группой фотографии (см. Выше) просто поразительны. Оказывается, люди, придумавшие рисунки в вашей книге по химии, были правы.
Техника, которую они использовали для получения этих потрясающих изображений, называется бесконтактной атомно-силовой микроскопией. У микроскопа есть единственный атом кислорода на кончике крошечной «иглы». Затем эта игла проходит по образцу, слегка перемещаясь каждый раз, когда проходит через молекулу или связь.Лазерный луч используется для определения того, насколько переместилась игла, и на основе этой информации формируется изображение.
Подобно тому, как игла в проигрывателе пластинок интерпретирует «неровности» разного размера в канавках записи как звук, «неровности» разного размера, обнаруженные микроскопом, затем превращаются в изображения.
До сих пор все рисунки молекул, которые мы когда-либо видели (или были вынуждены смотреть), были обоснованными предположениями, основанными на имеющейся научной информации.Теперь, благодаря фотографии на самом бесконечно малом уровне, ученым больше не нужно гадать. Это не сделает O-Chem более интересным, но, по крайней мере, теперь вы будете изучать то, что видели в реале.
(через Engadget)
Атомы, молекулы и ионы | CPD
Молекулы — важнейшие строительные блоки жизни. Без молекул воды жизнь на Земле не существовала бы. Всем живым организмам необходимы белковые молекулы для структуры и функционирования. Поэтому понимание того, как атомы объединяются в молекулы, является ключом к пониманию происхождения жизни.
В вашем классе
Загрузите инструкции, сетку и карточки с подсказками для четырехстрочного воспроизведения атомов, молекул и ионов в формате MS Word или pdf.
Загрузите инструкции, сетку и карточки с подсказками для четырехстрочного воспроизведения атомов, молекул и ионов с веб-сайта Education in Chemistry: rsc.li/2WayTn8
Что нужно знать студентам
Атомы, молекулы и ионы — все это примеры частиц, которые студенты могут встретить в 11–14 лет.Но эти термины часто неправильно используются в средствах массовой информации и в повседневной речи, что приводит к путанице учащихся всех возрастов в выборе правильного термина.
Студенты должны понимать, что:
- Частицы могут быть атомами , молекулами или ионами .
- Атомы — одиночные нейтральные частицы.
- Молекулы представляют собой нейтральные частицы, состоящие из двух или более атомов, связанных вместе.
- Ион — положительно или отрицательно заряженная частица.
Идеи для вашего класса
Идея о том, что мир состоит из крошечных частиц, является древней. Вы могли начать исследование атомов с идей Демократа (400 г. до н.э.), который считал, что вся материя во Вселенной состоит из крошечных неделимых твердых объектов. Он назвал эти объекты atoma или «неделимые единицы». В начале годов века Дальтон нашел доказательства, подтверждающие теорию Демократа, и предположил, что атомы представляют собой твердые сферы.Различные сферы составляли разные элементы.
Одна из ключевых проблем для студентов, изучающих атомы, заключается в том, что атомы малы. Действительно, очень маленький. Это затрудняет студентам концептуальное представление об атомах, поскольку их нельзя увидеть, потрогать или исследовать напрямую. Хорошей отправной точкой для знакомства с атомами и демонстрации их небольшого размера будет попросить учащихся разбить кусок графита (элемент углерода) на как можно больше мелких кусочков. Независимо от того, на сколько кусочков ученики разбивают графит, они никогда не получат ни одного атома углерода.Вы можете предложить ученикам с высшим образованием измерить размер отдельного атома, используя этот эксперимент из Практической физики.
Одна из ключевых проблем для студентов, изучающих атомы, заключается в том, что атомы малы. Действительно, очень маленький. Это затрудняет студентам концептуальное представление об атомах, поскольку их нельзя увидеть, потрогать или исследовать напрямую. Хорошей отправной точкой для знакомства с атомами и демонстрации их небольшого размера будет попросить учащихся разбить кусок графита (элемент углерода) на как можно больше мелких кусочков.Независимо от того, на сколько кусочков ученики разбивают графит, они никогда не получат ни одного атома углерода. Вы можете предложить ученикам с более высоким уровнем знаний измерить размер отдельного атома, используя этот эксперимент из Практической физики (bit.ly/2Km5cgt).
При объединении атомов образуется молекулы . Для нескольких элементов, когда атомы этого элемента объединяются, образуется молекула этого элемента, например H 2 и O 2 . Когда объединяются атомы некоторых различных элементов, может образоваться молекула соединения, например H 2 O.В серии 11–14 «Как обучать элементам и соединениям» описаны различные стратегии обучения элементам и соединениям, а также распространенные заблуждения, которые могут быть у учащихся.
При объединении атомов образуется молекулы . Для нескольких элементов, когда атомы этого элемента объединяются, образуется молекула этого элемента, например H 2 и O 2 . Когда объединяются атомы некоторых различных элементов, может образоваться молекула соединения, например H 2 O. Как учить элементы и соединения (rsc.li / 2W6MKut) в серии 11–14 описывает различные стратегии обучения элементам и соединениям, а также распространенные заблуждения, которые могут иметь ученики.
Диаграммы частиц могут использоваться, чтобы помочь учащимся визуализировать разницу между атомом, молекулой элемента и молекулой соединения. Фактически, даже Дальтон в 1800-х годах предложил серию диаграмм для представления элементов и соединений, известных в то время. Использование цвета помогает в дальнейшем различать типы атомов.Диаграммы Венна помогают учащимся организовать свое понимание различных типов частиц, как описано в разделе «Атомы, элементы, молекулы, соединения и смеси».
Диаграммы частиц могут использоваться, чтобы помочь учащимся визуализировать разницу между атомом, молекулой элемента и молекулой соединения. Фактически, даже Дальтон в 1800-х годах предложил серию диаграмм для представления элементов и соединений, известных в то время (рис. 1). Использование цвета помогает в дальнейшем различать типы атомов.Диаграммы Венна помогают учащимся организовать свое понимание различных типов частиц, как описано в разделе «Атомы, элементы, молекулы, соединения и смеси» (rsc.li/2wzLsxS).
Атом или молекула может потерять или получить электрон (ы) с образованием иона . На этом уровне учащимся нужно только знать, что ион — это положительно или отрицательно заряженная частица. Однако, возможно, на этом этапе стоит познакомить студентов с электроном. Когда атом / молекула получает отрицательно заряженный электрон (ы), образуется отрицательный ион.Когда атом / молекула теряет отрицательно заряженный электрон (ы), образуется положительный ион. Последний пункт — это то, с чем студенты часто сталкиваются позже в учебе. Введение электрона сейчас, до того, как студенты познакомятся с другими субатомными частицами, может помочь внедрить идею о том, что потеря электронов приводит к образованию положительно заряженного иона, и может помочь уменьшить путаницу в дальнейшем.
Из-за переплетения терминов атом, ион и молекула при описании различных частиц неудивительно, что студенты запутались.Использование игр и элемента соревнования может быть полезным для внесения некоторого разнообразия в необходимую студенческую практику. Одна из таких игр основана на классической игре Connect 4. Вы можете скачать инструкции, примерную сетку и игровые карточки ниже.
Распространенные заблуждения
По мере того, как учащиеся развивают свое понимание химической связи, они часто называют ионные соединения молекулами или ссылаются на межмолекулярные силы при объяснении свойств ионных соединений.Чтобы избежать этих неправильных представлений, важно ввести и подчеркнуть правильное использование терминов ион и молекула с самого начала в химических исследованиях студента.
Молекула — это нейтральная частица, состоящая из определенного количества атомов, связанных вместе. Частица вещества — это молекула, а не атомы, составляющие молекулу. Напротив, ионные соединения состоят из неопределенного числа ионов в фиксированном соотношении. Частица ионного вещества остается ионом.Использование практических моделей может помочь студентам понять эти сложные концепции — например, TIMSTAR MO84200 для молекул и Molymod MKO-127-27 для ионных структур. Вы можете дополнительно изучить использование химических моделей и их ограничения в разделе «Использование молекулярных моделей» и в серии «7 простых правил для преподавания естественных наук».
Молекула — это нейтральная частица, состоящая из определенного количества атомов, связанных вместе. Частица вещества — это молекула, а не атомы, составляющие молекулу.Напротив, ионные соединения состоят из неопределенного числа ионов в фиксированном соотношении. Частица ионного вещества остается ионом. Использование практических моделей может помочь студентам понять эти сложные концепции — например, TIMSTAR MO84200 для молекул и Molymod MKO-127-27 для ионных структур. Вы можете дополнительно изучить использование химических моделей и их ограничения в разделе «Использование молекулярных моделей» (rsc.li/2wAsOpA) и в серии «7 простых правил для преподавания естественных наук» (rsc.li/2XmwHKr).
Другие заблуждения, которые могут быть у студентов, обсуждаются в книге « За гранью видимости: неправильные представления студентов об основных химических идеях » (rsc.li / 2WBsd5L), в том числе то, что атомы имеют общие свойства объемного материала, а молекулы имеют разные свойства в разных состояниях.
Переход на 14–16
В 14–16 учеников знакомят с субатомными частицами и тем, как они определяют природу атомов и ионов. Затем студенты переходят к изучению разницы между природой сил, существующих между атомами, молекулами и ионами, которые они используют для объяснения физических свойств ионных и ковалентных соединений.
Ресурс «Почему атомы образуют ионы» позволяет учащимся оценить их понимание атомов, ионов и ионных соединений и позволяет учителю выявить любые заблуждения.
Ресурс «Почему атомы образуют ионы» (rsc.li/2Kptsyq) позволяет учащимся оценить их понимание атомов, ионов и ионных соединений и позволяет учителю выявить любые заблуждения.
Очки на вынос
- Частицы могут быть атомами, молекулами или ионами.
- Термин «молекула» часто используется неправильно для обозначения любого типа химического соединения.Молекула — это нейтральная частица, состоящая из двух или более атомов, связанных вместе.
- Будьте осторожны со своим родным языком, особенно когда говорите о соединениях, образующихся в ходе химических реакций. Сделайте различие между каждым типом частиц явным. Дайте учащимся возможность систематизировать свое понимание различных типов частиц с помощью диаграмм Венна.
- Хорошее понимание различных типов частиц поможет студентам, когда они изучают структуру и связь в возрасте 14–16 лет.
Здание молекулы
Введение
Набор для сборки молекул с шариком и клюшкой
Ковалентные связи образуются, когда электроны разделяются между атомами. Водород, например, может делить одну пару электронов с другим атомом, поэтому мы говорим, что он образует одну связь. Точно так же кислород образует два, азот обычно — три, а углерод формирует четыре. (Помните правило «HONC» … H = 1, O = 2, N = 3, C = 4, но учтите, что нестабильные молекулы могут образовываться, создавая исключения.) Коэффициенты атомов в различных молекулах выражаются их химическими формулы. Например, «H 2 O» представляет воду, а «C 6 H 12 O 6 » представляет глюкозу. Однако это только часть истории. В биологии форма молекула часто так же важна, как и ее химическая формула. Например, ферментам требуется точная трехмерная подходят к их основам, как бейсбольный мяч и поношенный перчатка аутфилдера. В этом исследовании мы попытаемся построить молекулярные модели некоторых распространенных веществ из биологии.В некоторых случаях появятся необычные свойства, которые нельзя было предсказать из плоские проекции, которые обычно рисуют на бумаге.
Общие группыПодсказки : эфир образуется, когда кислород имеет углерод с обеих сторон. Альдегид образуется, когда углерод присоединен к водороду и связан двойной связью с кислородом. Кетон образуется, когда C = O находится в середине углеродной цепи. Карбоновая кислота образуется, когда углерод связан двойной связью с одним кислородом и присоединен ко второму кислороду группой -O-H.Группа -O-H самостоятельно производит спирт .
Префиксы мет-эт-проп-бут-пент-гекс-гепт-окт-нон-дек- представляют возрастающее количество атомов углерода от 1 до 10.
Методы
Если вы проводите этот урок лично , используйте набор для построения молекул.
Мы будем работать с деревянными шарами для представления атомов. Водороды (белый или желтый) имеют одно отверстие, кислород (красный) имеет два отверстия, атомы азота (синий) имеют три отверстия, а угли (серый) имеют четыре отверстия.Используйте деревянные дюбели для одинарных соединений и гибкие пластиковые трубки для двойных облигации. Каждая дыра должна быть заполнена, каждая «связка» должна быть закрыта. Для некоторых из более крупных примеров может потребоваться поделиться частями с другие группы.
Поэкспериментируйте с каждым из следующих примеров, пока не получите удовлетворены тем, что у вас есть единственное правильное решение.
На отдельном листе бумаги нарисуйте каждый из этих примеров в виде Трехмерная форма, а не просто фигурка. Обозначьте каждый эскиз цветом как нужный.
Если вы проводите этот урок онлайн , используйте приложение Build a Molecule , чтобы построить молекулы, перечисленные ниже. Вы будете переходить от более простых структур к более сложным. Используйте вкладку «Большие молекулы» и нажимайте желтые стрелки, чтобы перемещаться между наборами атомов, чтобы найти тот, в котором есть все материалы, необходимые для каждой структуры. Просто перетащите атомы рядом друг с другом, и сформируется связь. Щелкните между атомами, чтобы разорвать связь. Выбросьте ненужные кусочки обратно в лоток, и они сами разберутся.Щелкните Refill Kit, чтобы очистить весь экран. В руководстве для учителей есть больше инструкций по использованию этого инструмента, но оно довольно интуитивно понятно, и вы, вероятно, сможете разобраться в нем через несколько минут изучения.
Создайте следующий
(Сначала попробуйте создать их, используя только подсказки ниже. Затем проверьте свою работу, щелкнув ссылку.)
- Водород газ — самая простая и мельчайшая из возможных молекул.
- Кислород газ требует двойной связи.
- Озон имеет химическую формулу O 3
- Двуокись углерода требует двух двойных связей. (Подсказка: ди- означает 2).
- Вы знакомы с водой (H 2 O), но перекись водорода , используемая для обесцвечивания волос и дезинфекции порезов, содержит еще один кислород.
- Добавьте один углерод в воду, и вы получите формальдегид , канцероген и консервант.
- Аммиак — простейшая из возможных молекул, состоящая из азота и водорода.
- Метан — простейшая из возможных молекул углерода и водорода.
- Метанол похож на метан, но также имеет один атом кислорода. Также называется древесным спиртом, он токсичен для питья.
- Этанол имеет формулу C 2 H 6 O. (Подсказка: требуется одна связь O-H!). Этанол — это алкоголь, содержащийся в пиве, вине и спиртных напитках.
- Диметиловый эфир представляет собой изомер этанола; то есть он имеет ту же химическую формулу, но другую структуру.(Подсказка: у него нет связи O-H!)
- Угольная кислота имеет формулу H 2 CO 3 и является критически важным буфером pH в вашей крови. (Подсказка: требуется одна двойная связь и никаких трехатомных колец!)
- Уксусная кислота при смешивании с водой образует уксус и имеет формулу C 2 H 4 O 2
- Мочевина имеет формулу CH 4 N 2 O. Именно так ваше тело выводит излишки азота из белков, которые вы едите.(Подсказка: левая и правая стороны симметричны!)
- Аланин — одна из самых простых аминокислот, из которых состоят белки. К его центральному атому углерода присоединены: атом водорода, аминогруппа (NH 2 ), метильная группа (CH 3 ) и карбоксильная группа (CO 2 H). Посмотрите, сможете ли вы построить второй, который будет зеркальным отражением оригинала.
Обсуждение
- Почему углерод был в основе всех более крупных примеров? Почему нет какой-нибудь другой атом, такой как водород или кислород?
- Если вы нашли зеркальное отображение своей модели аланина, было ли там каким-то образом вы могли повернуть или повернуть две версии, чтобы они идентичный? Почему или почему нет?
- Почему могут существовать правосторонние и левосторонние версии аланина, а не мочевину или угольную кислоту?
- Как могут молекулы с одинаковой химической формулой, такие как этанол и диметиловый эфир, иметь разные физические свойства?
- Когда вино или пиво подвергаются воздействию кислорода, этанол превращается в уксусную кислоту , и образуется вода.Сравните эти два соединения и запишите уравнение преобразования.
- В научно-фантастических фильмах идея жизни на основе кремния иногда предлагается как альтернатива углероду. Вы можете догадаться, почему? Подсказка: это рядом с углеродом в периодической таблице.
Дальнейшее расследование
Исследуйте периодику Таблица элементов на вашем Mac или воспользуйтесь этой онлайн-таблицей Менделеева. Если вам нужен более мощный конструктор молекул, попробуйте Jmol.
Упражнение по критическому мышлению : Узнайте о дигидрогене Моноксид, тихий убийца.
Первые изображения молекулы, которая создает и разрывает атомные связи.
Этот сайт может получать партнерские комиссии за ссылки на этой странице. Условия эксплуатации.Физики из лаборатории DoE в Беркли в Калифорнии впервые сделали снимки молекулы с высоким разрешением, когда она создает и разрывает химические связи с образованием различных молекул.Как вы можете видеть выше, самым шокирующим является то, что эти молекулы практически идентичны скелетным диаграммам, которые химики использовали почти столетие.
На изображении выше первая молекула слева — это органическая молекула, состоящая из трех бензольных колец, соединенных атомами углерода, сидящих на плоской серебряной подложке. Схема молекулы / скелета для молекулы — олиго- (фенилен-1,2-этиниленов) — показана ниже. Две молекулы справа были получены через несколько секунд после того, как произошла химическая реакция.Опять же, вы можете видеть, что новые молекулы очень и очень напоминают свои теоретические скелетные формулы.
В то время как большинство изображений на атомном уровне делается с помощью сканирующего туннельного микроскопа, эти изображения были получены с помощью бесконтактного атомно-силового микроскопа (nc-AFM, изображенный ниже). Там, где СТМ измеряет изменение электропроводности, когда крошечная игла проходит по образцу, АСМ вместо этого измеряет притяжение, вызванное атомными силами, когда острие микроскопа проходит очень близко к образцу.«То, что вы видите, — это то, что вы имеете — эффекты электронных сил между атомами и даже порядок связи. Вы можете различать одинарные, двойные и тройные связи », — говорит Феликс Фишер, руководивший исследованием.
Схема бесконтактного атомно-силового микроскопа (NC-AFM)
Хотя видеть реальную основу молекулярных диаграмм, которые десятилетиями валялись в учебниках и классных досках, это обнадеживает, это еще более поразительно, если вспомнить, что эти диаграммы из учебников были выведены без какого-либо прямого знания того, как выглядят молекулы.До сих пор мы понятия не имели, как на самом деле выглядят три бензольных кольца, соединенных атомами углерода; мы могли только предполагать это. Используя монументальную мощь испытанного научного метода, мы знаем, что углерод любит образовывать гексагональные кольца, и что отдельные атомы углерода могут соединяться с двумя кольцами тройными связями … и поэтому мы можем вывести скелетную диаграмму олигонуклеотидов. — (фенилен-1,2-этинилен).
